题目内容
12.对于某些常见离子的检验及结论一定正确的是( )| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钠溶液有白色沉淀产生,再加稀硝酸沉淀不消失,一定有Ag+ | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42- |
分析 A、二氧化碳和二氧化硫都能使澄清的石灰水变浑浊,气体为二氧化碳或二氧化硫;
B、氯化钠中产生沉淀的只有氯离子,沉淀为氯化银;
C、与碳酸钠产生沉淀的离子很多,如钡离子、钙离子、镁离子等;
D、氯化钡中含有钡离子和氯离子,不溶于盐酸的沉淀可能是硫酸钡,有可能氯化银.
解答 解:A、气体为二氧化碳或二氧化硫,则原溶液中可能含CO32-,或SO32-,或HCO3-、HSO3-,故A错误;
B、产生沉淀一定是氯化银,故原溶液中一定存在Ag+,故B正确;
C、白色沉淀可能是碳酸钡、碳酸钙等,故无法判断原溶液存在的离子,故C错误;
D、产生沉淀可能是硫酸钡,还可能是氯化银,原溶液不一定有硫酸根存在,故D错误;
故选B.
点评 本题考查阴阳离子的检验,难度不高,注重基础知识的考查.

练习册系列答案
相关题目
20.在探究新制饱和氯水成份的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向淀粉碘化钾溶液中滴加少量氯水,溶液变蓝,说明氯水中含有ClO- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
4.下列事实不能用勒夏特列原理解释的是( )
| A. | 光照新制的氯水时,溶液的pH逐渐减小 | |
| B. | 高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)?2NH3(g);△H<0) | |
| C. | 打开汽水瓶时,有大量气泡逸出 | |
| D. | 氨水应密闭保存于低温处 |
1.关于下列装置说法正确的是( )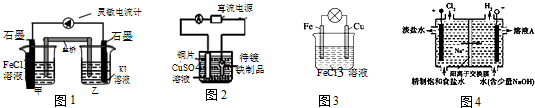

| A. | 装置①中,电流计读数为零后,在甲中溶入 FeCl2固体,乙中的石墨电极为正极 | |
| B. | 装置②中,外电路通过 1mol 电子时,铜片质量减轻 64g | |
| C. | 装置③是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 装置④的离子交换膜允许阳离子、阴离子、水分子自由通过 |
2.下列关于甲烷的说法错误的是( )
| A. | 甲烷高温分解 | B. | 甲烷能发生加聚反应 | ||
| C. | 甲烷是一种很好的燃料 | D. | 甲烷分子呈正四面体构型 |
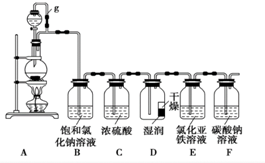 某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题: