��Ŀ����
2����ҵ��������������������Ҫ�ɷ�ΪFe2O3��FeO��SiO2�ȣ�Ϊԭ���Ʊ��ߵ��������죨Fe2O3�������������������£�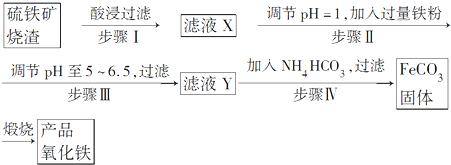
�Իش��������⣺
��1����ҺX�к��еĽ�����������Fe2+��Fe3+�������ӷ��ţ���
��2��������п�ѡ��B������Һ��pH������ĸ����
A��ϡ����B����ˮC������������ҺD�����������Һ
��3��������У�FeCO3������ȫ����Һ�к�������Fe2+������Fe2+�ķ�����ȡ������Һ���������軯����Һ�����Ժ�ɫ��Ȼ��μ���ˮ����Һ��Ϊ��ɫ��
��4���ڿ���������FeCO3���ɲ�Ʒ�������Ļ�ѧ����ʽΪ4FeCO3+O2$\frac{\underline{\;����\;}}{\;}$2Fe2O3+4CO2��
��5��3.84g Fe��Fe2O3�Ļ�������ڹ��������У�����0.03mol H2����Ӧ�����Һ�м���KSCN��Һ���飬��Һ���Ժ�ɫ����ԭ�������Fe2O3������1.6g
��6�������������������������ھ�ˮ����ԭ����Fe3++H2O=Fe��OH��3�����壩+3H+�������ӷ���ʽ��ʾ����
������أ�K2FeO4����Ϊˮ��������һ���ŵ�������ˮ��Ӧ���ɽ����������ʣ���ƽ�÷�Ӧ�����ӷ���ʽ��
FeO${\;}_{4}^{2-}$+10H2O�T4Fe��OH��3�����壩+3O2��+8OH-��
��7���������ǹ�ҵ��ұ������ԭ��֮һ����ԭ����Fe3O4+4CO$\frac{\underline{\;����\;}}{\;}$3Fe+4CO2������1.5mol Fe3O4�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ�����12mol��
���� ��������������������������������������������˺�õ�������Ϊ�������裬��Һ�м���������ۣ���������������Һ������pH�����̼�������Һ��������̼���������壬��ϴ�ӡ�����ڿ���������ʱ�����ֽ⣬��������е���������������ԭ��Ӧ����������������
��1��������������Ҫ�ɷ�ΪFe2O3��FeO��SiO2�ȣ����������������������ᷴӦ�ܽ⣬�������費���ᷴӦ�����жϣ�
��2�����ݲ����������������Һ��������Ϊ�������ӣ����������Լ�������ҺPH��5-6.5���Լ����������������ӣ������Ǽ���ǿ����Һ��
��3����Һ�к�������Fe2+����KSCN��Һ����ɫ���������������Ӻ���Կ���Ѫ��ɫ���ݴ˼���Fe2+��
��4������������̼����������̼��������������Ӧ�����������Ͷ�����̼��ԭ���غ���ƽд����
��5��3.84gFe��Fe2O3�Ļ�������ڹ��������У������ķ�ӦΪ��Fe2O3+6HCl�T2FeCl3+3H2O��2FeCl3+Fe�T3FeCl2��Fe+2HCl�TFeCl2+H2�������ݻ�ѧ����ʽ��ʽ���㣻
��6��������ˮ�����������������壬������������������أ�K2FeO4����Ϊˮ����������ˮ��Ӧ��������������������������ݵ���غ��д�����ӷ���ʽ��
��7���ڷ�ӦFe3O4+4CO$\frac{\underline{\;����\;}}{\;}$3Fe+4CO2�У�����+2�ۺ�+3�۱�Ϊ0�ۣ�ÿĦ��Fe3O4�μӷ�Ӧ��ת��8mol���ӣ��ݴ˼��㣮
��� �⣺��������������������������������������������˺�õ�������Ϊ�������裬��Һ�м���������ۣ���������������Һ������pH�����̼�������Һ��������̼���������壬��ϴ�ӡ�����ڿ���������ʱ�����ֽ⣬��������е���������������ԭ��Ӧ����������������
��1��������������Ҫ�ɷ�ΪFe2O3��FeO��SiO2�ȣ������������������ᷴӦ�ܽ⣬�������費���ᷴӦ���������ܽ�����������ӣ����������ܽ�������������ӣ�
�ʴ�Ϊ��Fe2+��Fe3+��
��2���ɲ����������������Һ��������Ϊ�������ӣ����������Լ�������ҺpH��5-6.5���Լ����������������ӣ�ǿ������Һ������������ӣ�
A��ϡ����������������������������ӣ���A�����ϣ�
B����ˮ��������Ե�����ҺPH����B���ϣ�
C������������Һ ��ǿ����Һ�����������������ӣ���C�����ϣ�
D�����������Һ�����������ԣ��������������ӣ���D�����ϣ�
��ѡB��
��3����Һ�к�������Fe2+����KSCN��Һ����ɫ���������������Ӻ���Կ���Ѫ��ɫ�����Լ���Fe2+�ķ�����ȡ������Һ���������軯����Һ�����Ժ�ɫ��Ȼ��μ���ˮ����Һ��Ϊ��ɫ��
�ʴ�Ϊ��ȡ������Һ���������軯����Һ�����Ժ�ɫ��Ȼ��μ���ˮ����Һ��Ϊ��ɫ��
��4������������̼����������̼��������������Ӧ�����������Ͷ�����̼����ԭ���غ���ƽ��Ӧ�Ļ�ѧ����ʽΪ4FeCO3+O2 $\frac{\underline{\;����\;}}{\;}$2Fe2O3+4CO2��
�ʴ�Ϊ��4FeCO3+O2 $\frac{\underline{\;����\;}}{\;}$2Fe2O3+4CO2��
��5����FeΪxmol��Fe2O3Ϊymol����Ӧ�ķ���ʽ�ֱ�ΪFe2O3+6HCl�T2FeCl3+3H2O��2FeCl3+Fe�T3FeCl2��Fe+2HCl�TFeCl2+H2�������ڷ�Ӧ�����Һ�м���KSCN���飬��Һ������������˵��FeCl3��ȫ��Ӧ����Һ��ֻ����FeCl2�����У�
Fe2O3+6HCl�T2FeCl3+3H2O��
ymol 2ymol
2FeCl3+Fe�T3FeCl2��
2ymol ymol
Fe+2HCl�TFeCl2+H2����
��x-y��mol 0.03mol
���У�$\left\{\begin{array}{l}{56X+160y=3.84}\\{x=y+0.03}\end{array}\right.$����֮�ã�x=0.04��y=0.01��
����Fe2O3������Ϊ0.01mol��160g/mol=1.6g��
�ʴ�Ϊ��1.6g��
��6��������ˮ�����������������壬��������������Ӧ�����ӷ���ʽΪFe3++H2O=Fe ��OH��3�����壩+3H+��������أ�K2FeO4����Ϊˮ����������ˮ��Ӧ�������������������������Ӧ�����ӷ���ʽΪ4FeO${\;}_{4}^{2-}$+10H2O�T4Fe��OH��3�����壩+3O2��+8OH-��
�ʴ�Ϊ��Fe3++H2O=Fe ��OH��3�����壩+3H+��4��10��4��3��8��
��7���ڷ�ӦFe3O4+4CO$\frac{\underline{\;����\;}}{\;}$3Fe+4CO2�У�����+2�ۺ�+3�۱�Ϊ0�ۣ�ÿĦ��Fe3O4�μӷ�Ӧ��ת��8mol���ӣ���������1.5mol Fe3O4�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ�����12 mol��
�ʴ�Ϊ��12 mol��
���� ���⿼���������仯�������ʵķ���Ӧ�ã���Ҫ�����̷�������ͷ�Ӧ���̵��жϣ���Ŀ�Ѷ��еȣ�

| A�� | ��ϡHNO3�ܽ�FeS���壺FeS+2H+�TFe2++H2S�� | |
| B�� | ������Һ�ʼ��Ե�ԭ��CO32-+2H2O?H2CO3+2OH- | |
| C�� | NaHSO4��Һ��Ba��OH��2��Һ��ϳ����ԣ�2HSO4-+Ba2++2OH-�TBaSO4��+SO42-+2H2O | |
| D�� | ������ͭ���������Cu��OH��2+2H+�TCu2++2H2O |
| A�� | Na2CO3 | B�� | HCl | C�� | H2O | D�� | NaOH |
| A�� | ����ϡ���������ɫ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ�һ����CO32- | |
| B�� | �����Ȼ�����Һ�а�ɫ�����������ټ�ϡ�����������ʧ��һ����Ag+ | |
| C�� | ����̼������Һ������ɫ�������ټ������ɫ������ʧ��һ����Ba2+ | |
| D�� | �����Ȼ�����Һ�а�ɫ�����������ټ������������ʧ��һ����SO42- |