题目内容
20.在探究新制饱和氯水成份的实验中,下列根据实验现象得出的结论不正确的是( )| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向淀粉碘化钾溶液中滴加少量氯水,溶液变蓝,说明氯水中含有ClO- | |
| D. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
分析 溶液中存在平衡Cl2+H2O?HCl+HClO,只有氯气有颜色,为黄绿色,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,而溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,溶液中氯气、HClO都强氧化性,都可以将碘化钾氧化生成碘单质,而使溶液变蓝.
解答 解:溶液中存在平衡Cl2+H2O?HCl+HClO,
A.只有氯气有颜色,为黄绿色,氯水呈浅黄绿色是由于含有氯气,故A正确;
B.溶液与硝酸银反应产生白色沉淀,只能是氯离子与银离子反应得到AgCl白色沉淀,说明氯水中含有Cl-,故B正确;
C.溶液中氯气、HClO都强氧化性,都可以将碘化钾氧化生成碘单质,而使溶液变蓝,不能说明氯水中含有ClO-,故C错误,
D.溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,故D正确;
故选C.
点评 本题考查氯水的性质,难度不大,侧重对基础知识的考查,需要学生熟练掌握基础知识.

练习册系列答案
相关题目
11.下列物质属于盐的是( )
| A. | Na2CO3 | B. | HCl | C. | H2O | D. | NaOH |
12.对于某些常见离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钠溶液有白色沉淀产生,再加稀硝酸沉淀不消失,一定有Ag+ | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42- |
9.下列对溶液叙述正确的是( )
| A. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| B. | 对于物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍和n倍后,若稀释后溶液的pH相等,则m<n | |
| C. | 在中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| D. | 25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw |
10.下列化学反应的离子方程式不正确的是( )
| A. | Fe(NO3)3溶液中加过量氨水:Fe3++3NH3•H2O═Fe(OH)3↓+3NH+4 | |
| B. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 氯化铵溶液与氢氧化钠溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应::Ba2++SO42-═BaSO4↓ |

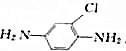 ,B与亚硝酸,在0~5℃反应后生成的产物与溴亚化铜和氰化钾反应生成C,C与氢氧化钠溶液共热生成2-氯-4-硝基苯酚,试推测A、B、C的构造式.
,B与亚硝酸,在0~5℃反应后生成的产物与溴亚化铜和氰化钾反应生成C,C与氢氧化钠溶液共热生成2-氯-4-硝基苯酚,试推测A、B、C的构造式.