题目内容
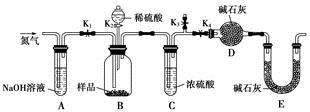
(本题共16分)锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是 。
(4)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。为了将Mn2+降到1.0×10-9mol/L,则c(Na2S)至少是 mol/L。

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是 。
(4)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。为了将Mn2+降到1.0×10-9mol/L,则c(Na2S)至少是 mol/L。
(1)MnCO3+H2 SO4 =MnSO4+ CO2↑+H2O(3分)
(2)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O (3分)(3)CoS和NiS (3分,错、漏均扣1分)
(4)阴(1分),Mn2++2e-=Mn (3分)(5)1.0×10-2 (3分)
(2)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O (3分)(3)CoS和NiS (3分,错、漏均扣1分)
(4)阴(1分),Mn2++2e-=Mn (3分)(5)1.0×10-2 (3分)
试题分析:(1)硫酸是强酸与碳酸锰反应生成硫酸锰、水和CO2,反应的化学方程式为MnCO3+H2 SO4 =MnSO4+ CO2↑+H2O。
(2)MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,而二氧化锰的还原产物是锰离子,反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。
(3)加氨水后除去了铁离子,溶液中的金属阳离子主要是锰离子、钴离子和镍离子,因此加入硫化铵后主要是生成CoS和NiS,即滤渣2的主要成分是CoS和NiS。
(4)锰离子得到电子被还原为单质锰,电解池中阴极得到电子被还原,所以在阴极析出Mn,电极反应方程式为Mn2++2e-=Mn。
(5)根据硫化锰的溶度积常数可知,当Mn2+降到1.0×10-9mol/L时,溶液中硫离子的浓度为
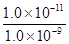 =0.01mol/L,即c(Na2S)至少是0.01mol/L。
=0.01mol/L,即c(Na2S)至少是0.01mol/L。
练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0 
 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。