题目内容
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为 。
(2)乙同学认为有Cu(OH)2生成的理论依据是 (用离子方程式表示)。
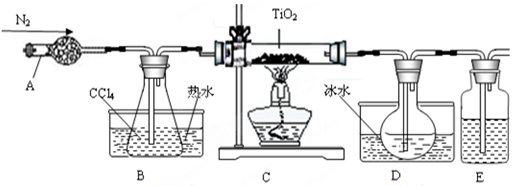
(3)两同学利用下图所示装置进行测定
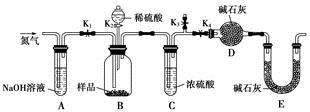
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是 (填选项序号,下同)。
若未进行步骤 ,将使测量结果偏低。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为 。
(4)丙同学认为还可以通过测量CO2的体积或测量 来测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为 。
(2)乙同学认为有Cu(OH)2生成的理论依据是 (用离子方程式表示)。
(3)两同学利用下图所示装置进行测定

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥。
②装置E中碱石灰的作用是 。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是 (填选项序号,下同)。
若未进行步骤 ,将使测量结果偏低。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为 。
(4)丙同学认为还可以通过测量CO2的体积或测量 来测定沉淀中CuCO3的质量分数。
(1)Cu2++2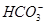 =CuCO3↓+CO2↑+H2O
=CuCO3↓+CO2↑+H2O
(2)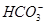 +H2O
+H2O H2CO3+OH-
H2CO3+OH-
(3)①过滤 ②防止空气中CO2和水蒸气进入装置D
③cab b ④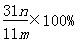
(4)样品质量和样品充分灼烧后的质量
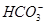 =CuCO3↓+CO2↑+H2O
=CuCO3↓+CO2↑+H2O(2)
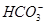 +H2O
+H2O H2CO3+OH-
H2CO3+OH-(3)①过滤 ②防止空气中CO2和水蒸气进入装置D
③cab b ④
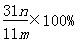
(4)样品质量和样品充分灼烧后的质量
(1)甲同学的观点认为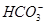
 H++
H++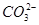 ,
,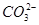 和Cu2+反应生成CuCO3沉淀,同时,H++
和Cu2+反应生成CuCO3沉淀,同时,H++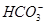
 H2CO3
H2CO3 H2O+CO2↑。
H2O+CO2↑。
所以离子方程式为
Cu2++2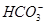 =CuCO3↓+CO2↑+H2O。
=CuCO3↓+CO2↑+H2O。
(2)乙同学认为有Cu(OH)2是由于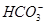 +H2O
+H2O H2CO3+OH-,Cu2+与OH-结合生成Cu(OH)2。
H2CO3+OH-,Cu2+与OH-结合生成Cu(OH)2。
(3)①分离沉淀采用过滤的方法,而净化沉淀须洗涤(洗去附着的离子)、干燥(除去水分)。
②装置D需准确称量,所以E中碱石灰是为了防止空气中的CO2和水蒸气进入D装置。
③一开始应排除系统内的空气,所以应关闭K2、K4,打开K1、K3;然后滴入稀硫酸使样品反应,所以应关闭K1、K3,打开K2、K4;为了使生成的CO2气体充分被吸收,应通入过量空气,此时应关闭K2、K3,打开K1、K4。若未进行最后一步,生成的CO2不能被充分吸收,造成所测结果偏低。
④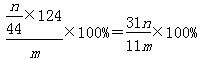
(4)通过CO2可求CuCO3,进一步求其质量分数;样品为CuCO3、Cu(OH)2,灼烧后为CuO,可列方程组求CuCO3的质量分数。
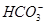
 H++
H++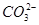 ,
,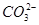 和Cu2+反应生成CuCO3沉淀,同时,H++
和Cu2+反应生成CuCO3沉淀,同时,H++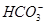
 H2CO3
H2CO3 H2O+CO2↑。
H2O+CO2↑。所以离子方程式为
Cu2++2
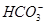 =CuCO3↓+CO2↑+H2O。
=CuCO3↓+CO2↑+H2O。(2)乙同学认为有Cu(OH)2是由于
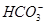 +H2O
+H2O H2CO3+OH-,Cu2+与OH-结合生成Cu(OH)2。
H2CO3+OH-,Cu2+与OH-结合生成Cu(OH)2。(3)①分离沉淀采用过滤的方法,而净化沉淀须洗涤(洗去附着的离子)、干燥(除去水分)。
②装置D需准确称量,所以E中碱石灰是为了防止空气中的CO2和水蒸气进入D装置。
③一开始应排除系统内的空气,所以应关闭K2、K4,打开K1、K3;然后滴入稀硫酸使样品反应,所以应关闭K1、K3,打开K2、K4;为了使生成的CO2气体充分被吸收,应通入过量空气,此时应关闭K2、K3,打开K1、K4。若未进行最后一步,生成的CO2不能被充分吸收,造成所测结果偏低。
④
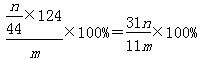
(4)通过CO2可求CuCO3,进一步求其质量分数;样品为CuCO3、Cu(OH)2,灼烧后为CuO,可列方程组求CuCO3的质量分数。

练习册系列答案
相关题目

 都看作
都看作 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的

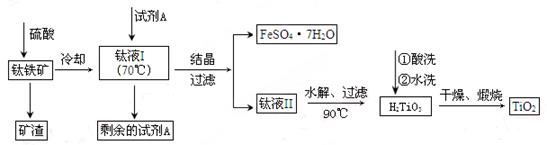
 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)