题目内容
(12分)【化学——化学与技术】
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
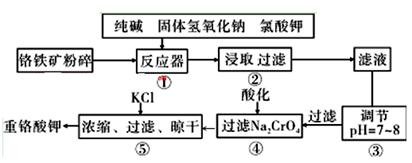
(1)碱浸前将铬铁矿粉碎的目的是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O

(1)碱浸前将铬铁矿粉碎的目的是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于
 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。| A.x ="0.5" ,a =8 | B.x ="0.5" ,a =" 10" | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
(1)增大接触面积,增大反应速率。(2分)
(2)Al(OH)3 H2SiO3。(2分)
(3)2CrO42-+2H+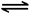 Cr2O72-+H2O (3分)
Cr2O72-+H2O (3分)
(4)温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应可以得到重铬酸钾。 (3分)(5)D(2分)
(2)Al(OH)3 H2SiO3。(2分)
(3)2CrO42-+2H+
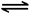 Cr2O72-+H2O (3分)
Cr2O72-+H2O (3分)(4)温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应可以得到重铬酸钾。 (3分)(5)D(2分)
试题分析:根据题给信息和流程判断,铬铁矿经操作①转化为Na2CrO4、Fe2O3、KCl、硅酸钠和偏铝酸钠,经操作②浸取过滤除去氧化铁,滤液中含有Na2CrO4、KCl、硅酸钠和偏铝酸钠,经操作③调节pH硅酸钠、偏铝酸钠水解生成氢氧化铝和硅酸沉淀而除去,滤液含有Na2CrO4、KCl,经操作④酸化转化为重铬酸钠,后续处理的重铬酸钾。(1)碱浸前将铬铁矿粉碎的目的是增大接触面积,增大反应速率。(2)步骤③调节pH后过滤得到的滤渣是Al(OH)3 H2SiO3。(3)操作④中,酸化时,CrO42-转化为Cr2O72-的离子方程式2CrO42-+2H+
 Cr2O72-+H2O。(4)操作⑤加入KC1的原因是温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应可以得到重铬酸钾。(5)根据铬原子守恒得,1mol Cr2O72-完全反应后生成2/2—xmolFeⅡ[FeⅢx?CrⅢ2-x]O4,根据铁原子守恒得amol=2(1+x)/2—xmol,该反应中得失电子数相等,1mol×2×(6-3)=2x/2—xmol(3-2),,解得x=1.5,将x=1.5带入amol=2(1+x)/2—xmol得a=10,选D。2O3,杂质为SiO2、Al2O3)为原料生产K2Cr2O7的主要工艺流程为载体考查影响反应速率的外界条件、物质的分离提纯和制备、电子守恒法计算。
Cr2O72-+H2O。(4)操作⑤加入KC1的原因是温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应可以得到重铬酸钾。(5)根据铬原子守恒得,1mol Cr2O72-完全反应后生成2/2—xmolFeⅡ[FeⅢx?CrⅢ2-x]O4,根据铁原子守恒得amol=2(1+x)/2—xmol,该反应中得失电子数相等,1mol×2×(6-3)=2x/2—xmol(3-2),,解得x=1.5,将x=1.5带入amol=2(1+x)/2—xmol得a=10,选D。2O3,杂质为SiO2、Al2O3)为原料生产K2Cr2O7的主要工艺流程为载体考查影响反应速率的外界条件、物质的分离提纯和制备、电子守恒法计算。
练习册系列答案
相关题目



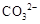 或
或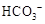

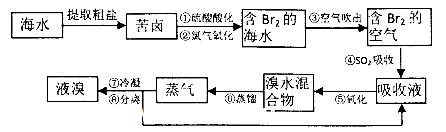
 都看作
都看作 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的