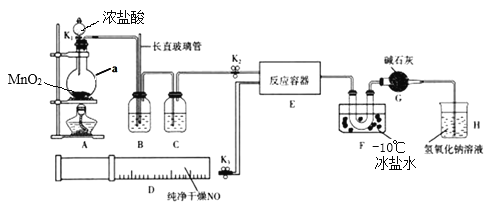
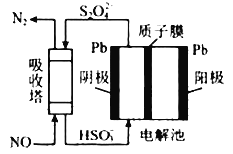
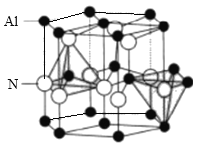
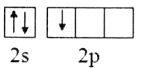
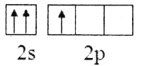
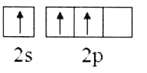
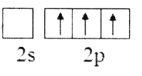
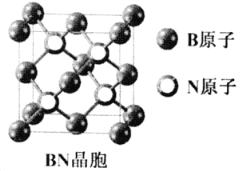
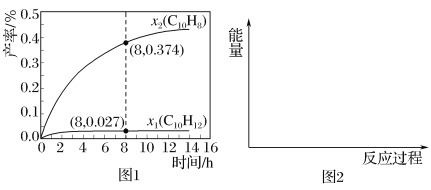
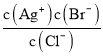题目内容
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力如图所示。回答下列问题:

(1)“O”点时液体不能导电,说明醋酸中________(填“含有”或“不含”)离子键。
(2)a、b、c三点醋酸电离程度由大到小的顺序为____________,a、b、c三点对应的溶液中c(H+)最大的是____。
(3)将等体积的a、b、c三点所对应的溶液用1 mol·L-1的NaOH溶液中和,消耗NaOH溶液体积由大到小的顺序____________。
(4)要使c点溶液中c(CH3COO-)增大而c(H+)减小,可采取的两种措施是加入____________。
(5)若实验测得c点处溶液中c(CH3COOH)=0.1 mol·L-1,c(CH3COO-)=0.001 mol·L-1,则该条件下CH3COOH的电离常数Ka=___________。
【答案】不含 c>b>a b a>b>c Zn(s)、NaOH(s)或醋酸钠 1.0×10-5
【解析】
冰醋酸是无水醋酸,加水稀释形成醋酸溶液,存在电离平衡CH3COOH![]() H++CH3COO-
H++CH3COO-
(1)“O”点时液体不能导电,说明“O”点时不存在自由移动的阴阳离子,冰醋酸中不含离子键,即CH3COOH是共价化合物,不含离子键;
(2)弱电解质溶液的浓度越小,弱电解质的电离度越大,a、b、c三点加水体积逐渐增大,所以醋酸电离程度逐渐增大即c>b>a ,由图知b点导电能力最大,则对应的溶液中c(H+)最大的是b点;
(3)等体积的酸,酸的浓度排序是a>b>c,等体积时酸的浓度越大,消耗NaOH溶液的体积越大,故消耗NaOH溶液体积由大到小的顺序a>b>c;
(4)由电离平衡CH3COOH![]() H++CH3COO-可知,要使c点溶液中c(CH3COO-)增大而c(H+)减小,可采取的措施是加入Zn(s)、Mg等金属、NaOH(s)、醋酸钠(s)、碳酸钠(s)等。
H++CH3COO-可知,要使c点溶液中c(CH3COO-)增大而c(H+)减小,可采取的措施是加入Zn(s)、Mg等金属、NaOH(s)、醋酸钠(s)、碳酸钠(s)等。
(5)c(CH3COO-)=c(H+)=0.001 mol·L-1 ,则Ka=![]() ,代入数据可得Ka=
,代入数据可得Ka=![]() 。
。