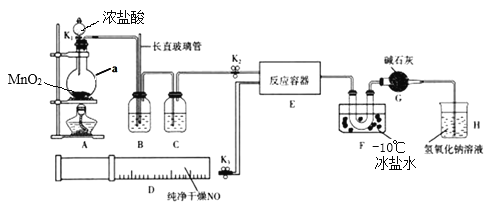
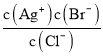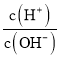题目内容
【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1
②2NH3(g)![]() N2(g)+3H2(g) △H2
N2(g)+3H2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=__(用△H1、△H2、△H3表示)。
(2)在2L密闭绝热容器中,投入4mol N2和6mol H2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如下表:
温度/K | T1 | T2 | T3 | T4 |
n(NH3)/mol | 3.6 | 3.2 | 2.8 | 2.0 |
①下列能说明该反应已达到平衡状态的是__。
A.3v正(H2)=2v逆(NH3) B.容器内气体压强不变
C.混合气体的密度不变 D.混合气的温度保持不变
②温度T1__(填“>”<”或“=”)T3。
③在T3温度下,达到平衡时N2的转化率为__。
(3)N2O4为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为__(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,v逆=__kPa·s-1。
2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为__(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,v逆=__kPa·s-1。
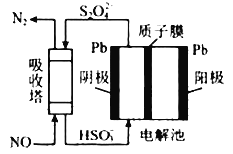
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图。阴极的电极反应式为__,电解槽中的隔膜为__(填“阳”或“阴”)离子交换膜。每处理1mol NO,电路中通过电子的物质的量为__。

【答案】2△H2-3△H1+3△H3 BD < 35% ![]() 2×105 2HSO3-+4H++2e-=S2O42-+2H2O 阳 2mol
2×105 2HSO3-+4H++2e-=S2O42-+2H2O 阳 2mol
【解析】
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1
②2NH3(g)![]() N2(g)+3H2(g) △H2
N2(g)+3H2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
利用盖斯定律,便可求出热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H;
(2)①A.3v正(H2)=2v逆(NH3),则v正(H2):v逆(NH3)=2:3;
B.容器内气体压强不变,则反应前后气体分子数不变;
C.混合气体的质量不变、体积不变,密度始终不变;
D.混合气的温度保持不变,则反应物的物质的量不再发生改变;
②从T1到T3,n(NH3)减小,说明平衡逆向移动,由此可确定温度T1与T3的关系;
③T在T3温度下,可利用三段式,求出达到平衡时N2的转化率;
(3)平衡时,v正= v逆,由此可求出该反应的化学平衡常数Kp;假设将1mol N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,由反应式N2O4(g)![]() 2NO2(g),可求出生成NO20.2mol,p(NO2)=
2NO2(g),可求出生成NO20.2mol,p(NO2)=![]() ,由此可求出v逆;
,由此可求出v逆;
(4)由图中可以看出,在阴极,SO32-→S2O42-,则阳极应为H2O失电子生成H+和O2,由此可写出阴极的电极反应式,电解槽中的隔膜类型,在NO吸收柱内发生反应S2O42-+2NO=2SO32-+N2,由此可算出每处理1mol NO,电路中通过电子的物质的量。
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1
②2NH3(g)![]() N2(g)+3H2(g) △H2
N2(g)+3H2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
利用盖斯定律,将2×②-3×①+3×③,便可求出热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=2△H2-3△H1+3△H3;答案为:2△H2-3△H1+3△H3;
(2)①A.3v正(H2)=2v逆(NH3),则v正(H2):v逆(NH3)=2:3,速率之比不等于化学计量数之比,反应未达平衡,A不合题意;
B.容器内气体压强不变,则反应前后气体分子数不变,反应达平衡状态,B符合题意;
C.混合气体的质量不变、体积不变,密度始终不变,不一定达平衡状态,C不合题意;
D.混合气的温度保持不变,则反应物的物质的量不再发生改变,反应达平衡状态,D符合题意;因此BD符合题意,答案为:BD;
②合成氨反应为放热反应,从T1到T3,n(NH3)减小,说明平衡逆向移动,从而表明温度升高,即温度T1<T3;答案为:<;
③T3温度下,在2L密闭绝热容器中,投入4mol N2和6mol H2,平衡时生成NH3 2.8mol,
建立三段式如下:

达到平衡时N2的转化率为![]() =35%;答案为:35%;
=35%;答案为:35%;
(3)平衡时,v正= v逆,k正·p(N2O4)= k逆·p2(NO2),该反应的化学平衡常数Kp=![]() =
= ![]() ;假设将1mol N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,由反应式N2O4(g)
;假设将1mol N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,由反应式N2O4(g)![]() 2NO2(g),可求出生成NO2 0.2mol,p(NO2)=
2NO2(g),可求出生成NO2 0.2mol,p(NO2)=![]() ,由此可求出v逆=k逆×p2(NO2)= 5×102kPa-1·s-1×(
,由此可求出v逆=k逆×p2(NO2)= 5×102kPa-1·s-1×(![]() )2=2×105 kPa·s-1;答案为:
)2=2×105 kPa·s-1;答案为:![]() ;2×105;
;2×105;
(4)由图中可以看出,在阴极,SO32-→S2O42-,则阳极应为H2O失电子生成H+和O2,由此可写出阴极的电极反应式2HSO3-+4H++2e-=S2O42-+2H2O;因为阳极生成H+,而阴极消耗H+,所以H+应从阳极迁移到阴极,电解槽中的隔膜应为阳离子交换膜;在NO吸收柱内发生反应S2O42-+2NO=2SO32-+N2,依据电子守恒,可算出每处理1mol NO(N 由+2价降为0价),电路中通过电子的物质的量2mol;答案为:2HSO3-+4H++2e-=S2O42-+2H2O;阳;2mol。

【题目】氢能被视为21世纪最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3
请回答下列问题:
(1)基态B原子的价电子排布式为___,B、C、N、O第一电离能由大到小的顺序为___,CH4、H2O、CO2的键角按照由大到小的顺序排列为___。
(2)与(HB=NH)3互为等电子体的有机分子为___(填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。
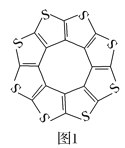
①C16S8分子中C原子和S原子的杂化轨道类型分别为___。
②相关键长数据如表所示:
化学键 | C—S | C=S | C16S8中碳硫键 |
键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能是___。
③C16S8与H2微粒间的作用力是___。
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为___。
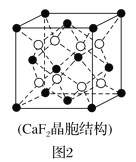
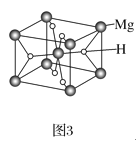
(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ag·cm-3,则晶胞的体积为___cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。