题目内容
17.为探究Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:| 实验 | 1、将一小块金属钠放入滴有酚酞溶液的冷水中. 2、将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. 3、将一小段镁带投入稀盐酸中. 4、将一小片铝投入稀盐酸中. |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
(1)在下表中填写与实验相对应的实验现象序号:
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐碱性,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
分析 (1)越是活泼的金属,和酸或者水反应越剧烈,置换出氢气越容易,生成碱的碱性越强;
(2)镁与水在加热条件下能够反应生成氢氧化镁和氢气;
(3)根据以上反应现象判断金属钠、镁、铝的活动性顺序;
(4)从原子半径和失电子能力角度来解释金属性强弱关系.
解答 解:(1)金属钠、镁、铝位于同一周期,按照从左到右的顺序失电子能力逐渐减小,和水及酸反应置换出氢气的程度是越来越难,所以:1对应的现象为②、2对应的现象为④、3对应的现象为①、4对应的现象为③,
故答案为:
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | ② | ④ | ① | ③ |
(3)根据金属和酸以及水的反应的剧烈程度,可以知道金属活动性顺序为:Na>Mg>Al,故答案为:金属活动性顺序为Na>Mg>Al;
(4)同周期元素从左到右核电荷数逐渐增多,原子半径逐渐减小,原子核对核外电子的吸引力逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱,
故答案为:减小;减弱;金属性.
点评 本题考查同一周期元素性质的递变规律知识,题目难度不大,注意熟练掌握元素周期律的内容及其应用.

练习册系列答案
相关题目
16.下列事实不能用勒沙特列原理来解释的是( )
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 密闭容器中发生反应H2+I2=2HI,增大压强时,容器中颜色加深 | |
| C. | 将混合气中的氨气液化后不停的分离出来,有利于合成氨的反应 | |
| D. | 用过量空气煅烧硫铁矿可以提高硫铁矿的利用率 |
12.三苯甲醇( )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
已知:(I)格氏试剂容易水解, ;
;

(Ⅱ)相关物质的物理性质如下:
(Ⅲ)三苯甲醇的分子量是260,纯净固体有机物一般都有固定熔点.请回答以下问题:
(1)图2中玻璃仪器B的名称:冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解;
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持微沸,可以采用水浴(方式)加热,优点是受热均匀,温度易于控制;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下 提纯方案,请填写如下空白:
其中,①操作为蒸馏;洗涤液最好选用:A(从选项中选);A、水 B、乙醚 C、乙醇 D、苯
检验产品已经洗涤干净的操作为:取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80m L(标准状况).产品中三苯甲醇质量分数为90%(保留两位有效数字.
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.已知:(I)格氏试剂容易水解,
 ;
;
(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
(1)图2中玻璃仪器B的名称:冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解;
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持微沸,可以采用水浴(方式)加热,优点是受热均匀,温度易于控制;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下 提纯方案,请填写如下空白:

其中,①操作为蒸馏;洗涤液最好选用:A(从选项中选);A、水 B、乙醚 C、乙醇 D、苯
检验产品已经洗涤干净的操作为:取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80m L(标准状况).产品中三苯甲醇质量分数为90%(保留两位有效数字.
9.下列说法正确的是( )
①需要加热才能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③一个化学反应是放热反应还是吸热反应,决定于反应物和生成物所具有的总能量的相对大小
④化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因.
①需要加热才能发生的反应一定是吸热反应
②放热反应在常温下一定很容易发生
③一个化学反应是放热反应还是吸热反应,决定于反应物和生成物所具有的总能量的相对大小
④化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因.
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
6.下列实验操作中所用仪器合理的是( )
| A. | 用 10 m 量筒量取 5.2 mL盐酸 | |
| B. | 用 100 mL量筒量取 5.2 mL盐酸 | |
| C. | 用托盘天平称取25.02g NaCl | |
| D. | 用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
 某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题:
某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图.在玻璃管中放入铁粉和石棉绒的混合物,加热,并通入水蒸气.用试管收集产生的干燥气体,并靠近火焰点火,观察现象.请回答下列问题: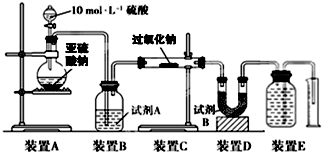 过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.
过氧化钠(Na2O2)是中学常见物质,常见的过氧化物还包括过氧化钙(CaO2).已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成.有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,CO2无强还原性,反应原理不相同.据此设计如下实验操作进行判断.