题目内容
5.将4mol A气体和2mol B气体在2L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g)若经2s 后测得C的浓度为0.6mol•L-1,那么,(1)用物质A表示的反应的平均速率为0.3mol/(L.min),用物质B表示的反应的平均速率为0.15mol/(L.min).
(2)2s时物质B的浓度为0.7mol/L,2s时物质A的转化率为30%.
分析 (1)根据v=$\frac{△c}{△t}$计算v(C),再根据速率之比等于化学计量数之比计算v(A)、v(B);
(2)浓度变化量之比等于化学计量数之比,据此计算B的浓度变化量,进而计算2S时B的浓度;
计算C的物质的量变化量,根据方程式计算转化的A的物质的量,根据转化率定义计算A的转化率.
解答 解:(1)2s后测得C的浓度为0.6mol•L-1,则v(C)=$\frac{0.6mol/L}{2s}$=0.3mol/(L.min),速率之比等于化学计量数之比,故v(A)=v(C)=0.3mol/(L.min),v(B)=$\frac{1}{2}$v(C)=$\frac{1}{2}$×0.3mol/(L.min)=0.15mol/(L.min),
故答案为:0.3mol/(L.min);0.15mol/(L.min);
(2)浓度变化量之比等于化学计量数之比,故B的浓度变化量=$\frac{1}{2}$×0.6mol•L-1=0.3mol/L,故2S时B的浓度为$\frac{2mol}{2L}$-0.3mol/L=0.7mol/L;
C的物质的量变化为2L×0.6mol•L-1=1.2mol,根据方程式可知转化的A的物质的量=1.2mol,故A的转化率=$\frac{1.2mol}{4mol}$×100%=30%,
故答案为:0.7mol/L;30%.
点评 本题考查化学平衡与化学反应速率的有关计算,难度不大,侧重对基础知识的巩固,注意反应速率通常利用定义法与速率规律计算.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
13.如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
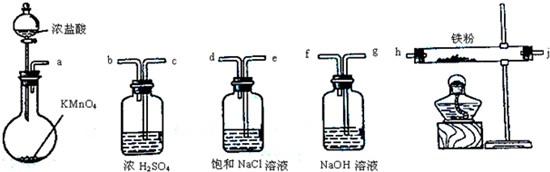

| A. | a-b-c-d-e-e-f-g-h | B. | a-e-d-c-b-h-j-g | ||
| C. | a-d-e-c-b-h-j-g | D. | a-c-b-d-e-h-j-f |
10.某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
(2)填写编号③④⑤的化学方程式
实验③2Na+2H2O=2NaOH+H2↑
实验④Mg+2HCl=MgCl2+H2↑,
实验⑤2Al+6HCl=2AlCl3+3H2↑;
(2)实验结论:同周期从左至右元素金属性减弱,非金属性增强.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
实验③2Na+2H2O=2NaOH+H2↑
实验④Mg+2HCl=MgCl2+H2↑,
实验⑤2Al+6HCl=2AlCl3+3H2↑;
(2)实验结论:同周期从左至右元素金属性减弱,非金属性增强.
17.为探究Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:
他们记录的实验现象有:
请帮助该小组同学补充下列实验报告中的内容.
(1)在下表中填写与实验相对应的实验现象序号:
(2)写出钠与水反应的化学方程式2Na+2H2O=2NaOH+H2↑.
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐碱性,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
| 实验 | 1、将一小块金属钠放入滴有酚酞溶液的冷水中. 2、将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. 3、将一小段镁带投入稀盐酸中. 4、将一小片铝投入稀盐酸中. |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
(1)在下表中填写与实验相对应的实验现象序号:
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
(3)实验结论是金属活动性顺序为Na>Mg>Al.
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐碱性,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此金属性逐渐减弱.
14.已知铯(Cs)位于元素周期表中第七周期,ⅠA族.试判断下列对于铯的性质的预测中,正确的是( )
| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
15.已知pH=1的某溶液中存在较多的Ba2+、NO3-,则该溶液中还可能大量存在的离子组是( )
| A. | Fe3+、F-、Cl- | B. | Mg2+、SO42-、Br- | C. | Mg2+、Cl-、Fe2+ | D. | Na+、NH4+、Cu2+ |