题目内容
【题目】亚氯酸钠(NaClO2)主要用于棉纺、亚麻、腈纶、涤纶等纤维漂白(不适于羊毛、绢丝、粘胶丝、尼龙等),也可用于食品、饮用水消毒、纸张漂白和鱼药制造。工业上常用电解法生产亚氯酸钠(NaClO2),请根据下面的工艺流程图回答下列问题:
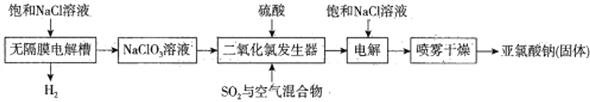
已知:纯的ClO2易分解爆炸。一般用稀有气体或空气稀释到10%以下安全。
(1)电解饱和NaCl溶液之前须除去其中的Ca2+、Mg2+、SO42-等杂质,依次加入BaCl2溶液、Na2CO3溶液、NaOH溶液,充分反应后将沉淀一并滤去,若经检测发现滤液中SO42-的浓度仍大于10-5mol·L -1,其可能的原因为____________________,滤液中c(CO32-)∶c(SO42-)为____________。[已知:Ksp(BaSO4 )= 1.0×10 -10,Ksp(BaCO3 )= 5.0×10-9 ]
(2)无隔膜电解槽内发生的反应中氧化产物、还原产物的物质的量之比为____________。
(3)将制得的ClO2 通入电解槽的阴极室,饱和NaCl溶液通入电解槽的阳极室,通电一段时间后可得到产品,电解时阴极的电极反应式为_____________________________。
(4)将ClO2 气体通入含CN-的电镀废水可得到对环境无污染的物质,反应的离子方程式为______________。
(5)ClO2溶液的浓度含量可用碘量法测定,其原理为在盐酸介质中ClO2与I-发生反应:2ClO2+8H++10I-=2Cl-+5I2+4H2O,再用Na2S2O3标准液滴定生成的I2,通过计算即可确定ClO2溶液浓度含量。已知:I2+2Na2S2O3=2NaI+Na2S4O6。
①滴定过程中需要滴加的指示剂为____________。
②取V1 mL的ClO2溶液加入到适量的盐酸和KI溶液中,反应完毕后再用0.lmol·L-1 的Na2S2O3溶液滴定反应后的溶液,若消耗了V2mL的Na2S2O3溶液,则ClO2 的浓度为____________ g·L-1。(杂质不参与反应,ClO2 的还原产物为Cl- )
【答案】 加入过量的Na2CO3溶液时,BaSO4(s)会分转化为BaCO3(s) ,从而释放出SO42- 50∶1 1∶3 ClO2+e-=ClO2- 2ClO2+ 2CN-=2CO2+N2+2Cl- 淀粉溶液 ![]()
【解析】(1)沉淀转化的方程式:BaSO4(s) +CO32-![]() BaCO3(s)+SO42-,平衡常数为c(SO42-)∶c(CO32-)=Ksp(BaSO4 ):Ksp(BaCO3 )= 1.0×10 -10:5.0×10-9=1:50,滤液中c(CO32-)∶c(SO42-)为50:1,在溶液中加入过量的Na2CO3溶液时,BaSO4(s)会分转化为BaCO3(s) ,从而释放出SO42-,导致滤液中SO42-的浓度仍大于10-5mol·L -1;(2)NaCl+3H2O
BaCO3(s)+SO42-,平衡常数为c(SO42-)∶c(CO32-)=Ksp(BaSO4 ):Ksp(BaCO3 )= 1.0×10 -10:5.0×10-9=1:50,滤液中c(CO32-)∶c(SO42-)为50:1,在溶液中加入过量的Na2CO3溶液时,BaSO4(s)会分转化为BaCO3(s) ,从而释放出SO42-,导致滤液中SO42-的浓度仍大于10-5mol·L -1;(2)NaCl+3H2O![]() NaClO3+3H2↑,无隔膜电解槽内发生的反应中氧化产物NaClO3、还原产物H2的物质的量之比为1∶3 ;(3)将制得的ClO2 通入阴极室,在阴极得电子制得亚氯酸盐,ClO2+e-=ClO2-;(4)将ClO2 气体通入含CN-的电镀废水可得到对环境无污染的物质,产物为二氧化碳和氮气,反应的离子方程式为2ClO2+ 2CN-=2CO2+N2+2Cl- ;(5)碘单质遇到淀粉呈蓝色,①滴定过程中需要滴加的指示剂为淀粉溶液;②由2ClO2+8H++10I-=2Cl-+5I2+4H2O,和I2+2Na2S2O3=2NaI+Na2S4O6得
NaClO3+3H2↑,无隔膜电解槽内发生的反应中氧化产物NaClO3、还原产物H2的物质的量之比为1∶3 ;(3)将制得的ClO2 通入阴极室,在阴极得电子制得亚氯酸盐,ClO2+e-=ClO2-;(4)将ClO2 气体通入含CN-的电镀废水可得到对环境无污染的物质,产物为二氧化碳和氮气,反应的离子方程式为2ClO2+ 2CN-=2CO2+N2+2Cl- ;(5)碘单质遇到淀粉呈蓝色,①滴定过程中需要滴加的指示剂为淀粉溶液;②由2ClO2+8H++10I-=2Cl-+5I2+4H2O,和I2+2Na2S2O3=2NaI+Na2S4O6得
关系式:2ClO2~5I2~10Na2S2O3,
135g 10mol
m 0.lmol·L-1×V2mL
![]() ,
,
V1mL的ClO2溶液ClO2的浓度为![]()

【题目】为了研究土壤的酸碱性,某学生做了如下实验:将一定体积的蒸馏水加入一定质量的土壤中,充分搅拌后,过滤并留取滤液,测滤液的pH后向滤液中滴加氨水,每加入2mL氨水就搅拌均匀并测量溶液的pH,所得实验记录如下:
加氨水体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液的pH | 4 | 4 | 4 | 4 | 6 | 8 | 10 | 10 | 10 |
利用上述记录的数据,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图,并根据曲线图回答下列问题:
(1)所测土壤的酸碱性如何?
(2)所用氨水的pH和c(OH﹣)分别为多少?
(3)为使该滤液呈中性,所加入氨水的恰当体积是多少?