题目内容
【题目】苯乙烯是工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:![]() (g)
(g)![]() (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为_____kJ·mol-1(用含有Q、b、c的表达式表示,其中Q、b、c均大于0)。
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a____________5。
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
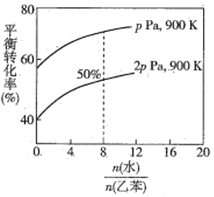
①加入水蒸气稀释剂能提高乙苯转化率的原因是________________________________。
②在实际生产过程中,当控制反应温度为900 K时生产效率最佳,选用此温度进行生产的原因为________ (答两点)。
③用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=_______。
④改变下列条件,能使乙苯的反应速率和转化率一定增大的是________ (填标号)。
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛: ![]() (g) + 2O2→
(g) + 2O2→![]() + CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
+ CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
【答案】 (Q+a-b) > 保持总压不变,充入水蒸气,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大(或体系总压强不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,乙苯转化率增大) 乙苯转化率较大;催化剂活性较高;反应速率较快(任答以上两点即可) ![]() B
B ![]() -8e-+3H2O=
-8e-+3H2O=![]() +8H++CO2 2
+8H++CO2 2
【解析】(1)工业上可用乙苯催化脱氢方法制备苯乙烯:![]() (g)
(g)![]() (g)+H2(g) △H=+QkJ·mol-1,①
(g)+H2(g) △H=+QkJ·mol-1,①![]() +21/2O2(g)→8CO2(g)+5H2O(l)△H=-akJ·mol-1,②
+21/2O2(g)→8CO2(g)+5H2O(l)△H=-akJ·mol-1,②![]() +10O2(g)→8CO2(g)+4H2O(l)△H=-bkJ·mol-1,③H2(g)+1/2O2(g)→2H2O(l)△H=-xkJ·mol-1,由盖斯定律可知,①-②-③得到
+10O2(g)→8CO2(g)+4H2O(l)△H=-bkJ·mol-1,③H2(g)+1/2O2(g)→2H2O(l)△H=-xkJ·mol-1,由盖斯定律可知,①-②-③得到![]() (g)
(g)![]() (g)+H2(g) △H=+QkJ·mol-1,a-b-x=Q,x= (Q+a-b);(2)恒容密闭容器中,物质的量与压强成正比,673K时,在一恒容密闭容器中充入5mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,a>5。(3)①加入水蒸气稀释剂能提高乙苯转化率的原因是保持总压不变,充入水蒸气,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大(或体系总压强不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,乙苯转化率增大)。②在实际生产过程中,当控制反应温度为900K时生产效率最佳,选用此温度进行生产的原因为:乙苯转化率较大、催化剂活性较高、反应速率较快(任答以上两点即可)。③取图象上900K,2p,转化率为50%的点,写出三段式,平衡时水为8体积,三种物质各0.5mol,用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,三种物质的分压均为2p×0.5/9.5,则900K时的平衡常数Kp
(g)+H2(g) △H=+QkJ·mol-1,a-b-x=Q,x= (Q+a-b);(2)恒容密闭容器中,物质的量与压强成正比,673K时,在一恒容密闭容器中充入5mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,a>5。(3)①加入水蒸气稀释剂能提高乙苯转化率的原因是保持总压不变,充入水蒸气,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大(或体系总压强不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,乙苯转化率增大)。②在实际生产过程中,当控制反应温度为900K时生产效率最佳,选用此温度进行生产的原因为:乙苯转化率较大、催化剂活性较高、反应速率较快(任答以上两点即可)。③取图象上900K,2p,转化率为50%的点,写出三段式,平衡时水为8体积,三种物质各0.5mol,用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,三种物质的分压均为2p×0.5/9.5,则900K时的平衡常数Kp
![]() (g)
(g)![]() (g)+H2(g)
(g)+H2(g)
开始 1
变化 0.5 0.5 0.5
平衡 0.5 0.5 0.5
Kp=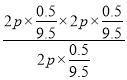 =2p/19
=2p/19
④A.恒容时加入稀释剂水蒸气,乙苯的分压、浓度不变,故A 错误; B.压强不变下,温度升至1500K,反应速率加快,平衡正向移动转化率增大,故B正确;C.在容积和温度不变下充入Ar,乙苯的分压、浓度不变,故C 错误;D.选用催化效果更好的催化剂,也不能使平衡移动,故D错误;故选B。(4)已知苯乙烯可催化氧化生成苯乙醛:![]() (g)+2O2→
(g)+2O2→![]() +CO2/span>+H2O,若把该反应设计为酸性燃料电池,苯乙烯作还原剂,在负极失电子,被氧化在苯乙醛和二氧化碳,则电池负极的电极反应式为.
+CO2/span>+H2O,若把该反应设计为酸性燃料电池,苯乙烯作还原剂,在负极失电子,被氧化在苯乙醛和二氧化碳,则电池负极的电极反应式为. ![]() -8e-+3H2O=
-8e-+3H2O=![]() +8H++CO2,根据反应方程式,每消耗2mol氧气,转移8mol电子,若该电池消耗标准状况下11.2L的O2,则外电路中理论上应转移电子的物质的量为2mol。
+8H++CO2,根据反应方程式,每消耗2mol氧气,转移8mol电子,若该电池消耗标准状况下11.2L的O2,则外电路中理论上应转移电子的物质的量为2mol。