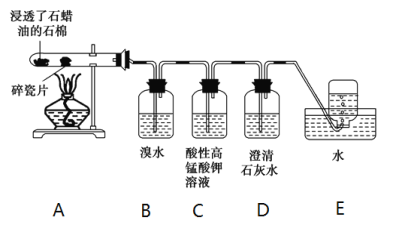
题目内容
【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是__________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是__________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/100gH2O]
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有__________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为__________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
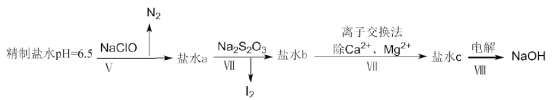
①过程V生成N2的离子方程式为__________。
②过程Ⅳ可以通过控制Na2S2O3的量,将IO3-还原成I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol·L-1的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为__________。
【答案】加快物质溶解 BaCl2溶液 BaCO3、Mg2(OH)2CO3 CO32-+2H+=CO2↑+H2O 2NH4++3ClO-=N2↑+3Cl-+2H++3H2O 8:5 89.28%
【解析】
粗盐在加热条件下溶解后加入氯化钡溶液,可除去SO42-,生成沉淀为BaSO4,滤液再加入碳酸钠,可生成CaCO3、Fe(OH)3、BaCO3、Mg2(OH)2CO3等沉淀,溶液中含有CO32-,加入盐酸除去CO32-,可得到精制盐水,以此解答(1)~(3);(4)精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,加入NaClO氧化NH4+生成氮气,然后加入Na2S2O3,将IO3-还原为I2,盐水b中含有Ca2+、Mg2+等,可用离子交换法除去,电解可得到氢氧化钠溶液,以此解答该题。
(1)将粗盐加水溶解需要适当加热,温度升高,可加快物质溶解;
(2)除去SO42-,可加入BaCl2溶液,生成BaSO4沉淀,即X为BaCl2溶液;
(3)①由表中数据可知,过程Ⅲ中生成的主要沉淀除CaCO3、Fe(OH)3外还有BaCO3、Mg2(OH)2CO3;
②滤液中含有过量的碳酸钠,过程Ⅳ中调节pH时发生的主要反应的离子方程式为CO32-+2H+=CO2↑+H2O;
(4)①加入NaClO氧化铵根生成氮气,方程式为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O;
②加入Na2S2O3的量,将IO3-还原成I2,且盐水b中含有SO42-,可知反应中IO3-为氧化剂,化合价由+5价降低到0价,Na2S2O3为还原剂,反应中S元素化合价由+2价升高到+6价,总共升高8价,则氧化剂和还原剂的物质的量之比为8:5;
③表中第二次实验数据误差较大,可舍去,则其它两次平均值为(29.12-0.30+29.88-1.10)mL/2=28.80mL,则n(I2)=0.0288L×0.0500molL-1=1.44×10-3mol,由反应2S2O32-+I2=S4O62-+2I-可知25.00mL溶液中n(Na2S2O3)=2.88×10-3mol,则250mL溶液中含有0.0288mol Na2S2O3,则8.00g样品中Na2S2O3的纯度为(0.0288mol×248g/mol)/8g×100%=89.28%。