题目内容
【题目】“绿水青山就是金山银山”,当前氮的氧化物的污染日趋严重,某企业处理该污染物的原理设计为燃料电池如图所示。在处理过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法不正确的是( )
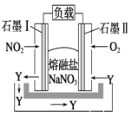
A. 该电池放电时电子流动的方向是:石墨Ⅰ电极→负载→石墨Ⅱ电极→熔融NaNO3→石墨Ⅰ电极
B. 石墨Ⅱ附近发生的反应:O2+4e-+2N2O5=4NO3-
C. O2在石墨Ⅱ附近发生还原反应,Y为N2O5
D. 相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
【答案】A
【解析】
以NO2、O2、熔融NaNO3组成的燃料电池,在使用过程中石墨I电极为原电池的负极,NO2被氧化,N元素化合价升高,应生成N2O5,电极方程式为NO2+NO3--e-═N2O5,石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,以此解答该题。
A.电子流动的方向是:石墨Ⅰ电极→负载→石墨Ⅱ电极,A项错误;
B.石墨Ⅱ是正极发生还原反应,电极反应式为:O2+4e-+2N2O5=4NO3-,B项正确;
C.石墨Ⅱ通入氧气,发生还原反应,负极的NO2被氧化,N元素化合价升高,Y应是N2O5,C项正确;
D.电极方程式分别为NO2+NO3--e-═N2O5,、O2+2N2O5+4e-═4NO3-,根据电子转移数守恒可知,放电过程中消耗的NO2和O2的体积比为4:1,D项正确;
答案选A。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】下列叙述正确的是
A. 摩尔是物质的量的单位
B. 摩尔是一个基本物理量
C. N2的摩尔质量为28g
D. 0.1 mol NaCl溶解在IL水中,所得溶液中NaCl的物质的量浓度为0.1mol/L
【题目】在2 L密闭容器中进行反应:aX(s)+bY(g)![]() cP(g)+dQ(g),式中a、b、c、d为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
cP(g)+dQ(g),式中a、b、c、d为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | P | Q |
起始/mol | 0.5 | 1.0 | 1.5 | |
2min末/mol | 0.7 | 2.7 | 0.8 | |
3min末/mol | 2.7 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,v(P)∶v(Y)=2∶5。
(1)试确定以下物质的相关量:起始时n(Y)=______,2min末时n(Q)=______。
(2)上述反应的化学方程式为_________
(3)用Y表示2 min内的反应速率为______。2min末,Q在混合气体的体积分数为_____
(4)在保持温度和容积不变的情况下,下列关于上述反应的叙述不正确的是_____
a.2 min内用X表示的反应速率为0.05mol·L-1·min-1
b.向容器内充入稀有气体Ar(不参与反应),会导致体系压强增大,反应速率加快
c.随着反应的进行,混合气体的平均相对分子质量不再改变即说明反应已经达到平衡
d.随着反应的进行,混合气体的密度不再改变即说明反应已经达到平衡
e.随着反应的进行,混合气体的压强不再改变即说明反应已经达到平衡