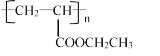��Ŀ����
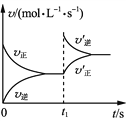
����Ŀ��ij�¶��£�HNO2��CH3COOH�ĵ��볣���ֱ�Ϊ5.0��10-4��1.7��10-5����pH��ͬ�������ΪV0����������Һ�ֱ��ˮϡ�������V��pH��![]() �ı仯��ͼ��ʾ�����������������
�ı仯��ͼ��ʾ�����������������
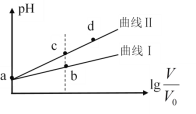
A.����������CH3COOH��Һ
B.��Һ��ˮ�ĵ���̶ȣ�b��С��c��
C.��ͬ���a���������ֱ���NaOH��Һǡ���кͺ���Һ��n(NO2��)��n(CH3COO��)
D.��c�㵽d�㣬��Һ��![]() ���ֲ��䣨����HA��A���ֱ������Ӧ�����������ӣ�
���ֲ��䣨����HA��A���ֱ������Ӧ�����������ӣ�
���𰸡�C
��������
�ɵ��볣����֪��HNO2��CH3COOH�������ᣬ���Ҵ�������Ը�����pH��ͬ�������ΪV0����������Һ�У���������ʵ������������
A. ��ͬpH�������ˮϡ�ͣ�����Խǿ���ᣬpH�仯Խ����������������CH3COOH��Һ����ȷ��
B.��ͼ�п��Կ�������Һ��pH b��С��c�㣬˵��c(H+)b���c���c(OH-) c���b��Ӷ�˵����Һ��ˮ�ĵ���̶�c���b�����ȷ��
C. ��ͬ���a��������ᣬ��������ʵ����ֱ���NaOH��Һǡ���кͺ���Һ��n(NO2��)<n(CH3COO��)������
D. ��c�㵽d�㣬����ĵ��볣����ˮ�ĵ��볣�������䣬����Kw/Ka���䣬��![]() ���ֲ��䣬��ȷ��
���ֲ��䣬��ȷ��
�ʴ�ΪC��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��һ���¶��£�10mL0.40molL-1H2O2��MnO2�����·�����Ӧ ��2H2O2 ( aq)=2H2O(l )+O2( g) ��H <0�� ��ͬʱ�̲ⶨ����O2�����ʵ������±���ʾ ��
t/min | 0 | 3 | 6 | 10 | ����. |
n(O2)/mol | 0.0 | 0.0008 | 0.001 | 0.0012 | ����. |
������������ȷ���ǣ���Һ����仯���Բ��ƣ�
A.�����¶ȣ��ɼӿ�H2O2 �ķֽ�����
B.��������Һ��ʼŨ�ȣ����ռ��� 0.0 008 mol O2 ��ʱ���С��3 min
C.��Ӧ�� 6min ʱ����Һ �� c(H2O2)=0.2mol L-1
D.��Ӧ�� 12min ʱ��H2O2�ֽ���Ϊ 65%