题目内容
3.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )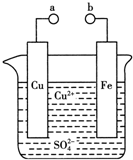
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu | |
| C. | a和b用导线相连时,电能转变为化学能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
分析 A、a和b不连接时,Fe与硫酸铜溶液发生置换反应;
B、a和b用导线连接时,形成原电池,Fe作负极,Cu作正极;
C、a和b用导线连接时,电解质溶液为硫酸铜,形成原电池,化学能转变为电能;
D、无论a和b是否连接,都发生Fe+Cu2+=Fe2++Cu.
解答 解:A、a和b不连接时,Fe与硫酸铜溶液发生置换反应,则在铁片上有金属铜析出,故A正确;
B、a和b用导线连接时,电解质溶液为硫酸铜,形成原电池,Cu作正极,发生还原反应,电极反应为Cu2++2e-=Cu,故B正确;
C、a和b用导线连接时,电解质溶液为硫酸铜,形成原电池,化学能转变为电能,故C错误;
D、无论a和b是否连接,都发生Fe+Cu2+=Fe2++Cu,则溶液从蓝色逐渐变成浅绿色,故D正确;
故选C.
点评 本题考查化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
8.用下列装置图进行相应的实验,其中正确的是( )
| A. | 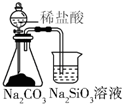 用此图可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 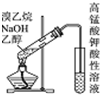 用此图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| C. |  根据此图装置中U型管液面现象,证明装置漏气 | |
| D. | 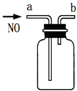 用此图装置收集一瓶纯净的NO |
18.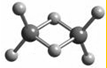 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n,常用作还原剂 .已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量.Al2H6的球棍模型如图所示.下列说法错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n,常用作还原剂 .已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量.Al2H6的球棍模型如图所示.下列说法错误的是( )
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n,常用作还原剂 .已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量.Al2H6的球棍模型如图所示.下列说法错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n,常用作还原剂 .已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量.Al2H6的球棍模型如图所示.下列说法错误的是( )| A. | Al2H6中Al为-3价,H为+1价 | |
| B. | Al2H6中含有离子键和极性共价键 | |
| C. | Al2H6在固态时所形成的晶体是分子晶体 | |
| D. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
15.某化学反应中,反应物B的物质的量浓度在20s内,从2.0mol/L变成了 1.Omol/L,则这20s内B的反应速率为( )
| A. | 0.05 | B. | 0.05mol/L | C. | 0.5 mol/(L.s) | D. | 0.05 mol/(L.s) |
12.在一定温度下,可逆反应X(g)+3Y(g)?2Z(g)达到平衡的标志是( )
| A. | X生成的速率与Z分解的速率相等 | |
| B. | 单位时间生成a molX,同时生成3a molY | |
| C. | X、Y、Z的分子数比为1:3:2 | |
| D. | X、Y、Z的浓度不再变化 |
13.下列关于胶体的叙述正确的是( )
| A. | 胶体都是无色、透明的 | |
| B. | 可以通过丁达尔现象鉴别胶体和溶液 | |
| C. | 可以用滤纸分离淀粉和KI的混合液 | |
| D. | 胶粒在电场作用下均会产生电泳现象 |
 在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g
在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g