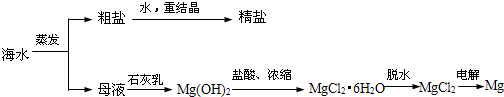
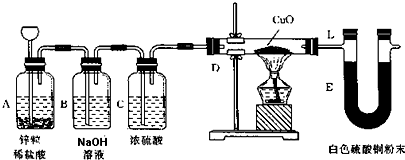
题目内容
6.某种有机物在气态时对H2的相对密度为30,充分燃烧3.0g此有机物可得3.36L二氧化碳(标准状况)和3.6g 水.此有机物能与金属钠反应,求此有机物的分子式和可能的结构简式.(要求有计算过程)分析 该有机物在气态时对H2的相对密度为30,则其摩尔质量为60g/mol,据此可以计算出3.0g该有机物的物质的量,再计算二氧化碳、水的物质的量,利用原子守恒计算分子中C、H原子数目,结合相对分子质量确定是否含有氧元素,若含有氧元素,计算氧原子数目,进而确定有机物分子,该有机物能够与金属钠反应,说明分子中至少含有-OH、-COOH中的一种,结合分子式确定可能的结构简式.
解答 解:该有机物在气态时对H2的相对密度为30,则其摩尔质量为:2g/mol×30=60g/mol,则3.0g该有机物的物质的量为$\frac{3.0g}{60g/mol}$=0.05mol,
标准状况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,n(C)=n(CO2)=0.15mol,
3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,n(H)=2n(H2O)=0.4mol,
则有机物分子中N(C)=$\frac{0.15mol}{0.05mol}$=3、N(H)=$\frac{0.4mol}{0.05mol}$=8,C、H原子总相对原子质量为12×3+1×8=44<60,故该有机物一定含有O元素,则分子中氧原子数目为$\frac{60-44}{16}$=1,所以该有机物的分子式为:C3H8O,
由于该有机物能够与金属钠反应生成氢气,则其分子中一定含有-OH,所以该有机物的结构简式可能为:CH3CH2CH2OH、CH3CH(OH)CH3,
答:该有机物的分子式为C3H8O;其结构简式可能为CH3CH2CH2OH、CH3CH(OH)CH3.
点评 本题考查有机物分子式与结构简式确定的计算,注意掌握确定有机物分子式的方法,熟练掌握官能团的性质,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 0.6mol酒精 | B. | 标准状况下4.48L SO2 | ||
| C. | 0.36g H2O | D. | 含NA个氢原子的甲烷 |
| A. | 聚乙炔是乙炔发生聚合反应形成的高聚物 | |
| B. | 聚乙炔的化学式为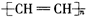 | |
| C. | 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质 | |
| D. | 等质量的聚乙炔和乙烯分别完全燃烧时,它们耗氧量相同 |
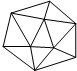 晶体硼的结构如图所示.已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子.下列有关说法不正确的是( )
晶体硼的结构如图所示.已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子.下列有关说法不正确的是( )| A. | 每个硼分子含有12个硼原子 | B. | 晶体硼是空间网状结构 | ||
| C. | 晶体硼中键角是60° | D. | 每个硼分子含有30个硼硼单键 |
| A. | 溶液的导电性能相同 | |
| B. | 与足量的锌粉反应的起始速率相同 | |
| C. | 与足量的锌粉反应产生氢气的体积比为1:2:100 | |
| D. | 与同浓度氢氧化钠溶液反应,消耗氢氧化钠溶液的体积为1:1:100 |
| A. | 纯水的电离度α(25℃)>α(100℃) | |
| B. | 水电离时其热效应是△H>0的过程 | |
| C. | 纯水中的c(H+)随着温度的降低而增大 | |
| D. | 在100℃时,纯水依然呈中性,则c(H+)=c(OH-)=1.0×10-7mol•L-1 |