题目内容
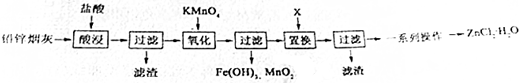
1.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,从海水制备金属镁的流程如图所示: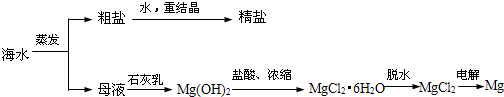
(1)为了节约成本,充分利用滩涂资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO、CaO+H2O═Ca(OH)2.
(2)Mg(OH)2沉淀中混有的Ca(OH)2,可通过加入MgCl2溶液,充分搅拌,过滤,沉淀再用水洗涤而除去.写出反应的化学方程式:MgCl2+Ca(OH)2═Mg(OH)2+CaCl2.
(3)写出电解熔融MgCl2制得金属镁的化学方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
分析 (1)碳酸钙在高温条件下分解生成CaO与二氧化碳,氧化钙和水会生成氢氧化钙;
(2)氢氧化钙和氯化镁反应会生成氢氧化镁沉淀和氯化钙;
(3)电解熔融MgCl2制得金属镁和氯气.
解答 解:(1)贝壳的主要成份是碳酸钙,碳酸钙在高温条件下分解生成CaO与二氧化碳,可以制备氧化钙,反应方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,氧化钙和水反应会生成氢氧化钙:CaO+H2O=Ca(OH)2,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+H2O=Ca(OH)2;
(2)氢氧化钙和氯化镁发生复分解反应:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2,生成氢氧化镁沉淀和氯化钙,
故答案为:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
(3)电解熔融MgCl2制得金属镁和氯气,反应的化学方程式为:MgCl2 $\frac{\underline{\;通电\;}}{\;}$ Mg+Cl2↑,
故答案为:MgCl2 $\frac{\underline{\;通电\;}}{\;}$ Mg+Cl2↑.
点评 本题考查了从海水中提取镁的原理和方法,侧重考查石灰乳的制备以及石灰乳中加入MgCl2溶液的反应,题目难度不大.

练习册系列答案
相关题目
13.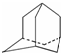 烃A分子的立体结构如图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名“金刚烷”,金刚烷分子中有( )
烃A分子的立体结构如图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名“金刚烷”,金刚烷分子中有( )
 烃A分子的立体结构如图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名“金刚烷”,金刚烷分子中有( )
烃A分子的立体结构如图(其中C、H原子已略去);因其分子中碳原子排列类似金刚石故名“金刚烷”,金刚烷分子中有( )| A. | 2个-CH3结构 | B. | 4个-CH2-结构 | C. | 4个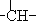 结构 结构 | D. | 6个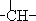 结构 结构 |
10.下列化学试剂的保存不正确的是( )
| A. | 金属钠保存煤油中 | B. | 浓硝酸存放于棕色试剂瓶中 | ||
| C. | 白磷保存在水中 | D. | NaOH溶液用玻璃塞密封保存 |
 已知CO和CO2混合气体的质量为14.4g,在标准状况下的体积为8.96L,试回答下列问题:
已知CO和CO2混合气体的质量为14.4g,在标准状况下的体积为8.96L,试回答下列问题: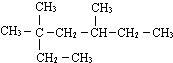 3,3,5-三甲基庚烷
3,3,5-三甲基庚烷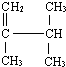 2,3-二甲基-1-丁烯
2,3-二甲基-1-丁烯 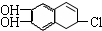 中含有的官能团的名称为羟基、碳碳双键和氯原子.
中含有的官能团的名称为羟基、碳碳双键和氯原子.