题目内容
【题目】室温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1的CH3COOH 溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
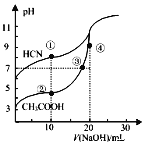
A. 当加入10mLNaOH时:c(CH3COOH)>c(HCN)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 已知室温下某碱AOH的Kb=1×10-9,则ACN的水溶液呈碱性
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
【答案】C
【解析】A项,根据图像,当加入10mLNaOH溶液时,点②得到等物质的量浓度的CH3COOH和CH3COONa的混合液,点②溶液呈酸性,CH3COOH的电离程度大于CH3COO-的水解程度,溶液中粒子浓度由大到小顺序为c(CH3COO-)![]() c(Na+)
c(Na+)![]() c(CH3COOH),点①得到等物质的量浓度的HCN和NaCN的混合液,点①溶液呈碱性,CN-的水解程度大于HCN的电离程度,溶液中粒子浓度由大到小顺序为c(HCN)
c(CH3COOH),点①得到等物质的量浓度的HCN和NaCN的混合液,点①溶液呈碱性,CN-的水解程度大于HCN的电离程度,溶液中粒子浓度由大到小顺序为c(HCN)![]() c(Na+)
c(Na+)![]() c(CN-),加入10mLNaOH溶液时,两溶液中c(Na+)相等,两溶液中c(CH3COOH)
c(CN-),加入10mLNaOH溶液时,两溶液中c(Na+)相等,两溶液中c(CH3COOH)![]() c(HCN),A项错误;B项,点③和点④在NaOH滴定CH3COOH溶液过程中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),点③溶液的pH=7,点③溶液中c(H+)=c(OH-),点③溶液中c(Na+)=c(CH3COO-),点④加入20mLNaOH溶液充分反应后得到CH3COONa溶液,点④溶液中由于CH3COO-的水解溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)
c(HCN),A项错误;B项,点③和点④在NaOH滴定CH3COOH溶液过程中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),点③溶液的pH=7,点③溶液中c(H+)=c(OH-),点③溶液中c(Na+)=c(CH3COO-),点④加入20mLNaOH溶液充分反应后得到CH3COONa溶液,点④溶液中由于CH3COO-的水解溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)![]() c(CH3COO-)
c(CH3COO-)![]() c(OH-)
c(OH-)![]() c(H+),B项错误;C项,根据图像0.1mol/L的HCN溶液的pH
c(H+),B项错误;C项,根据图像0.1mol/L的HCN溶液的pH![]() 5即c(H+)
5即c(H+)![]() 1
1![]() 10-5mol/L
10-5mol/L![]() 0.1mol/L,HCN的电离方程式为HCN
0.1mol/L,HCN的电离方程式为HCN![]() H++CN-,HCN的电离平衡常数Ka(HCN)=
H++CN-,HCN的电离平衡常数Ka(HCN)=![]()
![]() =1
=1![]() 10-9=Kb(AOH),ACN属于弱酸弱碱盐,根据盐类水解的规律“谁强显谁性”,ACN的水溶液呈碱性,C项正确;D项,点②所示溶液为等物质的量浓度的CH3COOH和CH3COONa的混合液,点②溶液呈酸性,CH3COOH的电离程度大于CH3COO-的水解程度,溶液中粒子浓度由大到小顺序为c(CH3COO-)
10-9=Kb(AOH),ACN属于弱酸弱碱盐,根据盐类水解的规律“谁强显谁性”,ACN的水溶液呈碱性,C项正确;D项,点②所示溶液为等物质的量浓度的CH3COOH和CH3COONa的混合液,点②溶液呈酸性,CH3COOH的电离程度大于CH3COO-的水解程度,溶液中粒子浓度由大到小顺序为c(CH3COO-)![]() c(Na+)
c(Na+)![]() c(CH3COOH),溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),点②溶液中c(CH3COO-)+c(OH-)
c(CH3COOH),溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),点②溶液中c(CH3COO-)+c(OH-)![]() c(CH3COOH)+c(H+),根据点③加入NaOH溶液的体积,点③溶液由CH3COONa和略过量的CH3COOH组成,点③溶液的pH=7,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),点③溶液中c(Na+)=c(CH3COO-),c(Na+)
c(CH3COOH)+c(H+),根据点③加入NaOH溶液的体积,点③溶液由CH3COONa和略过量的CH3COOH组成,点③溶液的pH=7,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),点③溶液中c(Na+)=c(CH3COO-),c(Na+)![]() c(CH3COOH),则c(CH3COO-)+c(OH-)
c(CH3COOH),则c(CH3COO-)+c(OH-)![]() c(CH3COOH)+c(H+),D项错误;答案选C。
c(CH3COOH)+c(H+),D项错误;答案选C。

【题目】下列实验操作、现象以及原因完全对应的是
实验操作 | 实验现象 | 原因 | |
A | 室温下,向浓度均为0.01mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)< Ksp(CaSO4) |
B | 将水蒸气通过灼热的铁粉 | 铁粉变为红色 | 铁可以与水在高温下发生反应 |
C | 向淀粉水解的产物中加入新制的银氨溶液 | 没有出现银镜现象 | 催化剂与新制的银氨溶液发生了反应 |
D | 相同温度下,将相同大小钠块分别加到水、醋酸、乙醇中 | 生成氢气的速率:醋酸>水>乙醇 | 三种电解质电离H+能力:醋酸>水>乙醇 |
A. A B. B C. C D. D

