题目内容
1.某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.上图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )
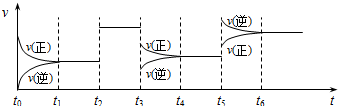
| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时增大了压强 | D. | t4~t5时间内转化率最高 |
分析 A.由图可知,t2时改变条件,正逆反应速率增大且相等;
B.t3时改变条件,正逆反应速率均减小,且正反应速率大于逆反应速率;
C.t5时改变条件,正逆反应速率增大,且逆反应速率大于正反应速率;
D.催化剂对平衡移动无影响,t3~t4时间内平衡正向移动,转化率增大,t5~t6时间内平衡逆向移动,转化率减小.
解答 解:A.该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,由图可知,t2时改变条件,正逆反应速率增大且相等,不可能是改变压强,则t2时加入了催化剂,故A正确;
B.t3时改变条件,正逆反应速率均减小,且正反应速率大于逆反应速率,若改变体积,正、逆反应速率降低,且正反应速率降低更多,平衡向逆反应移动,该反应正反应是放热反应,降低温度,正、逆反应速率降低,平衡正向移动,与图象相符,故B正确;
C.t5时改变条件,正逆反应速率增大,且逆反应速率大于正反应速率,若增大压强,平衡正向移动,与图象不符,故C错误;
D.由上述分析可知,t2时刻,使用催化剂,平衡不移动,X的转化率不变,t3时刻,降低温度,平衡向正反应移动,X的转化率增大,t5时刻,升高温度,平衡向逆反应移动,X的转化率降低,故在t4~t5时间内转化率最高,故D正确;
故选C.
点评 本题考查化学反应速率的影响因素及图象,明确反应为放热反应且为体积缩小的反应结合平衡移动与速率大小的关系即可解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有机化合物的名称错误的是( )
| A. | 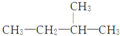 2-甲基丁烷 2-甲基丁烷 | B. |  3-乙基戊烷 3-乙基戊烷 | C. |  2-乙基戊烷 2-乙基戊烷 | D. |  2,3-二甲基丁烷 2,3-二甲基丁烷 |
12.Na、Mg、O、Cl四种元素中只能以离子键结合的化合物有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16. 在密闭容器中通入CH4与CO2,使其物质的量浓度均为0.1mol•L-1,在一定条件下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),测得平衡时CH4的转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )
在密闭容器中通入CH4与CO2,使其物质的量浓度均为0.1mol•L-1,在一定条件下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),测得平衡时CH4的转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )
 在密闭容器中通入CH4与CO2,使其物质的量浓度均为0.1mol•L-1,在一定条件下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),测得平衡时CH4的转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )
在密闭容器中通入CH4与CO2,使其物质的量浓度均为0.1mol•L-1,在一定条件下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),测得平衡时CH4的转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )| A. | 上述反应的△H<0 | B. | 压强P1<P2<P3<P4 | ||
| C. | 1100℃该反应的平衡常数为64 | D. | 压强为P4时,在Y点:v(正)<v(逆) |
6.下列元素中,属于第ⅣA族的是( )
| A. | 钠 | B. | 镁 | C. | 碳 | D. | 氮 |
13.反应2C(s)+O2(g)=2CO(g) 的能量变化如图所示,下列说法正确的是( )

| A. | 生成物的总能量大于反应物的总能量 | |
| B. | △H<0,表明该反应在常温下一定能发生 | |
| C. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| D. | 该反应的热化学方程式是:2C(s)+O2(g)=2CO(g)△H=-110.5 kJ/mol |
10.下列有机物中,属于烷烃的是( )
| A. | C2H6 | B. | C2H2 | C. | C6H6 | D. | C2H4O |
 2NH3.
2NH3.