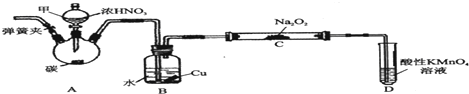
题目内容
9.金属是一种重要的材料,人类的生活和生产都离不开金属,从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.(1)每年世界上钢铁的产量很高,但钢铁的腐蚀也给人类带来了巨大的损失,铁在潮湿的空气中锈蚀主要属于电化学中的吸氧腐蚀;
(2)铝的活动性比铁强,但铝在空气中却比铁表现出良好的抗腐蚀性,如家庭中“钢精锅”是由铝合金做成的,它能长期使用的原因是铝表面形成致密的氧化膜;
(3)下列关于铁制品保护措施的说法中不正确的是②(填序号);
①衣架和电线外面包上一层塑料层以防锈;
②相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用;
③在海轮的外壳上常焊有锌块,且定期更新;
④在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油.
(4)炒过菜的铁锅未及时洗净(残液中含有氯化钠),第二天便出现红棕色的锈斑(该锈主要成分为Fe(OH)3失水后的产物).试用有关电极反应式、化学方程式表示Fe(OH)3的生成过程.
负极:Fe-2e-═Fe2+正极:O2+2H2O+4e-═4OH-;电池总反应:2Fe+O2+2H2O═2Fe(OH)2;其它反应:4Fe(OH)2+O2+2H2O═4Fe(OH)3.
分析 (1)电化学腐蚀分为吸氧腐蚀和析氢腐蚀,以吸氧腐蚀较普遍;
(2)铝能在空气中形成一层致密的氧化膜;
(3)钢铁生锈的条件是钢铁与氧气和水同时接触;酸性溶液、碱性溶液、盐溶液能促进金属生锈,防止金属生锈的方法有:在金属表面涂一层油漆;在金属表面镀一层金属;根据原电池原理进行保护等;
(4)钢铁中碳、铁和电解质溶液构成原电池发生吸氧腐蚀,铁作负极,碳作正极,负极上铁失去电子发生氧化反应,正极上氧气得电子发生还原反应,二价铁离子和氢氧根离子生成氢氧化亚铁,氢氧化亚铁被氧化生成氢氧化铁,氢氧化铁失去部分水生成铁锈.
解答 解:(1)电化学腐蚀分为吸氧腐蚀和析氢腐蚀,吸氧腐蚀的发生是当水膜呈弱酸性或中性时,析氢腐蚀是当水膜呈较强酸性时,故以吸氧腐蚀较普遍,故答案为:吸氧;
(2)铝能在空气中形成一层致密的氧化膜,保护着内部的铝不再受腐蚀,故答案为:致密的氧化膜;
(3)①衣架和电线外面包上一层塑料层以防锈,可以防止金属与空气接触,能防止金属被腐蚀,故①正确;
②相同条件下,马口铁中的铁作原电池负极,加快铁被腐蚀,白铁中的铁作原电池正极,能防止铁被腐蚀,所以白铁更为耐用,故②错误;
③在钢材制造的大型船舶上装上一定数量的锌块,Fe、Zn形成原电池时,Fe作正极被保护,故③正确;
④自行车的钢圈和车铃上镀上一层铬,摩擦部位加上机油或黄油,能防止金属与空气接触,可以防止生锈,故④正确;
故选②;
(4)中性溶液中,钢铁中碳、铁和电解质溶液构成原电池发生吸氧腐蚀,负极上铁失电子生成二价铁离子,电极反应式为Fe-2e-=Fe2+;
正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-;
亚铁离子和氢氧根离子反应生成氢氧化亚铁,即总反应:电池总反应:2Fe+O2+2H2O═2Fe(OH)2;
氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁4Fe(OH)2+O2+2H2O=4Fe(OH)3,最后,氢氧化铁失去部分水生成带结晶水 的氧化铁Fe2O3.xH2O,即铁锈的主要成分.
故答案为:负极:Fe-2e-═Fe2+;正极:O2+2H2O+4e-═4OH-;
电池总反应:2Fe+O2+2H2O═2Fe(OH)2;
其它反应:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
点评 本题考查了金属的腐蚀与防护,难度不大,明确酸性溶液中钢铁主要腐蚀析氢腐蚀,中性或碱性溶液中钢铁腐蚀吸氧腐蚀.

| A. | 2mol•L-1 | B. | 7.8mol•L-1 | C. | 8mol•L-1 | D. | 1.9mol•L-1 |
| A. | 维生素是构成人体细胞和组织的重要材料 | |
| B. | 维生素能为人体提供能量 | |
| C. | 维生素调节新陈代谢、预防疾病和维持身体健康 | |
| D. | 维生素都溶于水 |
| A. | P、Q、R、S的物质的量浓度之比为:1:1:1:1 | |
| B. | P、Q、R、S在密闭容器中共存 | |
| C. | P、Q、R、S的物质的量浓度不再变化 | |
| D. | v(Q)=v(R) |
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )
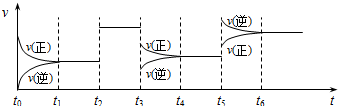
| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时增大了压强 | D. | t4~t5时间内转化率最高 |
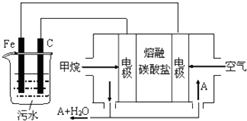
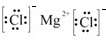 .
.