题目内容
13.反应2C(s)+O2(g)=2CO(g) 的能量变化如图所示,下列说法正确的是( )
| A. | 生成物的总能量大于反应物的总能量 | |
| B. | △H<0,表明该反应在常温下一定能发生 | |
| C. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| D. | 该反应的热化学方程式是:2C(s)+O2(g)=2CO(g)△H=-110.5 kJ/mol |
分析 根据图示可知C(s)+$\frac{1}{2}$O2(g)=2CO(g)△H=-110.5kJ/mol.
A、该反应为放热反应,生成物的总能量小于反应物的总能量;
B、根据△G=△H-T△S<0,反应自发判断;
C、一氧化碳反应生成二氧化碳过程是放热反应;
D、焓变与反应物的系数成正比.
解答 解:A、该反应为放热反应,生成物的总能量小于反应物的总能量,故A错误;
B、因为△G=△H-T△S<0,反应自发,所以△H<0,还要看△S,则不能表明该反应在常温下一定能发生,故B错误;
C、2mol C(s)与足量O2(g)反应生成CO2(g),反应过程中一氧化碳生成二氧化碳是放热反应,所以放出的热量大于221kJ,故C正确;
D、焓变与反应物的系数成正比,所以该反应的热化学方程式是2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,故D错误;
故选C.
点评 本题考查反应能量变化分析,反应焓变理解和计算方法,图象分析判断能力,题目难度中等.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | SO3、NH3的水溶液均能导电,所以均是电解质 | |
| B. | 蔗糖、酒精在水溶液中和熔融态时均不导电,所以它们是非电解质 | |
| C. | 液态硫酸、固态硫酸钡不能导电,所以二者均不是电解质 | |
| D. | 钢铁、石墨均导电,所以它们是电解质 |
4.关于维生素的叙述正确的是( )
| A. | 维生素是构成人体细胞和组织的重要材料 | |
| B. | 维生素能为人体提供能量 | |
| C. | 维生素调节新陈代谢、预防疾病和维持身体健康 | |
| D. | 维生素都溶于水 |
1.某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0.上图表示该反应的速率(v)随时间
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )
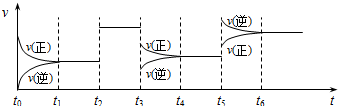
(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )

| A. | t2时加入了催化剂 | B. | t3时降低了温度 | ||
| C. | t5时增大了压强 | D. | t4~t5时间内转化率最高 |
8.下列有机物中,属于糖类的是( )
| A. | 油脂 | B. | 淀粉 | C. | 酒精 | D. | 蛋白质 |
5. 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 醋酸中逐滴加入氨水 |
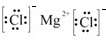 .
.