题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)写出元素③的离子结构示意图_________,该离子半径________S2-(填“﹥”或“﹤”) ;
(2)上述元素中最高价氧化物对应的水化物的酸性最强的是(填化学式,下同)_________;
(3)上述元素中金属性最强的是_________,写出其与水反应的化学方程式____________;
(4)由④、⑧、⑩三种元素形成的简单氢化物的沸点由高到低的顺序是_______________;
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因是______(用化学方程式来表示);标况下将一装满该气体的试管倒立于水槽中,足够时间后,水面会上升到 试管容积的________处,所得试管内溶液物质的量浓度为___________mol/L(假设溶质全部留在试管中);
(6)设计实验验证比较元素③、⑦的非金属性强弱:_________。
【答案】![]() < HClO4 K 2K +2H2O=2KOH +H2↑ HF > HBr > HCl 3NO2 + H2O = NO + 2HNO3 2/3 1/22.4 ①向硫化氢溶液中通入氧气,溶液出现浑浊,发生的反应为:2H2S+O2=2S↓+2H2O,依据氧化还原的规律可知,氧化性比较:O2>S,故可证明非金属性:O > S;②铁在硫蒸气中加热可得到硫化亚铁,而铁在氧气中点燃则得到四氧化三铁,同样与铁反应,得到的铁的价态越高,对应单质的氧化性越强,则元素非金属性越强,故可证明非金属性:O > S。
< HClO4 K 2K +2H2O=2KOH +H2↑ HF > HBr > HCl 3NO2 + H2O = NO + 2HNO3 2/3 1/22.4 ①向硫化氢溶液中通入氧气,溶液出现浑浊,发生的反应为:2H2S+O2=2S↓+2H2O,依据氧化还原的规律可知,氧化性比较:O2>S,故可证明非金属性:O > S;②铁在硫蒸气中加热可得到硫化亚铁,而铁在氧气中点燃则得到四氧化三铁,同样与铁反应,得到的铁的价态越高,对应单质的氧化性越强,则元素非金属性越强,故可证明非金属性:O > S。
【解析】
由元素在周期表中的位置可知,①为B、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为K、⑩为Br,
(1)依据满8电子稳定结构书写其离子方程式;结合简单离子半径的比较方法回答;
(2)非金属性越强,最高价氧化物对应的水化物的酸性越强;
(3)依据元素金属性的周期性变化规律作答;
(4)简单氢化物的沸点从氢键与范德华力两个因素综合考虑;
(5)该红棕色气体为二氧化氮,二氧化氮与水反应生成硝酸与NO,故二氧化氮不能用排水法收集;
(6)比较O与S的非金属性强弱,可从比较其单质的氧化性强弱考虑。
有上述分析可知,①为B、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为K、⑩为Br,
(1)元素③为O元素,最外层电子数为6,则其离子结构示意图为:![]() ;电子层数越大,对应简单离子半径越大,因O2-的电子层数比S2-的多,则对应的离子半径小于S2-,
;电子层数越大,对应简单离子半径越大,因O2-的电子层数比S2-的多,则对应的离子半径小于S2-,
故答案为:![]() ;<;
;<;
(2)同周期从左到右元素非金属性依次增强;同主族元素从上到下,非金属性依次减弱;且非金属性越强,对应的最高价氧化物对应的水化物中酸性越强;因F无最高价,所以酸性最强的为HClO4,
故答案为:HClO4;
(3)在元素周期表中,同周期从左到右元素金属性依次减弱,同主族元素中从上到下元素金属性依次增强,在上述元素中,金属性最强的为K,可以水反应生成相应的氢氧化物与氢气,其化学方程式为:2K +2H2O=2KOH +H2↑,
故答案为:2K +2H2O=2KOH +H2↑;
(4)④、⑧、⑩三种元素形成的简单氢化物分别为HF、HCl、HBr,因HF分子间存在氢键,则沸点最高,HBr的相对分子质量比HCl的大,则沸点从大到小依次为:HF > HBr > HCl,
故答案为:HF > HBr > HCl;
(5)该红棕色气体为二氧化氮,二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=2HNO3+NO,故二氧化氮不能用排水法收集;依据方程式可知,气体体积减少![]() ,则标况下将一装满该气体的试管倒立于水槽中,足够时间后,水面会上升到试管容积的
,则标况下将一装满该气体的试管倒立于水槽中,足够时间后,水面会上升到试管容积的![]() 处,假设试管的体积为V,则在标砖状况下,气体的物质的量为
处,假设试管的体积为V,则在标砖状况下,气体的物质的量为![]() ,根据物质的量浓度公式可知,c=
,根据物质的量浓度公式可知,c=![]() ,
,
故答案为:3NO2+H2O=2HNO3+NO;2/3;1/22.4;
(6)依据单质的氧化性强弱来作为非金属性判断的依据之一,可设计实验如下:
①向硫化氢溶液中通入氧气,溶液出现浑浊,发生的反应为:2H2S+O2=2S↓+2H2O,依据氧化还原的规律可知,氧化性比较:O2>S,故可证明非金属性:O > S;
②铁在硫蒸气中加热可得到硫化亚铁,而铁在氧气中点燃则得到四氧化三铁,同样与铁反应,得到的铁的价态越高,对应单质的氧化性越强,则元素非金属性越强,故可证明非金属性:O > S。
答案合理可酌情给分。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
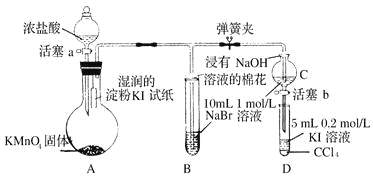
轻松课堂标准练系列答案【题目】下列实验能达到相应实验目的的是
选 项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z | |||
A | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 |
|
B | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
C | Na2CO3 | 醋酸 | Na2SiO3溶液 | 证明酸性: CH3COOH > H2CO3 >H2SiO3 | |
D | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
A. AB. BC. CD. D