题目内容
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持、加热仪器已略去,气密性已检验)。
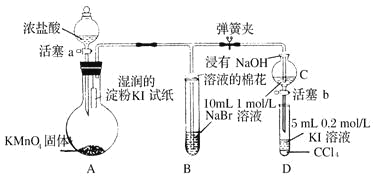
实验过程;
I.打开弹簧夹,打开活塞a,清加浓盐酸。II.当 B 和C 中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。Ⅳ……
(1)A中产生的是黄绿色气体,其离子方程式为____________,在该反应中浓盐酸表现了___________性。
(2)验证氯气的氧化性强于碘的实验现象是___________________________。
(3)B 中溶液发生反应的离子方程式是__________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________。
(5)过程Ⅲ实验的目的是__________________________。
(6)从元素周期表的递变规律的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:_____________。
【答案】2MnO4-+16H++10Cl- = 2Mn2+ + 5Cl2↑+ 8H2O 酸性、还原性 湿润的淀粉-KI 试纸变蓝 Cl2+2Br-=Br2+2Cl- 打开活塞b,将少量C 中溶液滴入D 中,关闭活塞 b,取下D 振荡,静置后CCl4 层溶液变为紫红色 确认C 的黄色溶液中无 Cl2,排除Cl2 对溴置换碘实验的干扰 同主族元素从上到下,原子半径逐渐增大,得电子能力逐渐减弱
【解析】
(1)A中产生黄绿色气体为Cl2,依据氧化还原反应的规律书写其离子方程式;根据氯元素守恒结合方程式分析浓盐酸的作用;
(2)根据氧化剂的氧化性大于氧化产物的氧化性,并检验产物碘;
(3)根据氧化剂的氧化性大于氧化产物的氧化性;
(4)根据氧化剂的氧化性大于氧化产物的氧化性,并检验产物碘的存在;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰.;
(6)从原子结构(电子层数、原子半径)的角度分析.
(1)因KMnO4与浓HCl反应可以用来制Cl2,其离子方程式为:2MnO4-+16H++10Cl- = 2Mn2+ + 5Cl2↑+ 8H2O,在该反应中浓盐酸表现了酸性和还原性。
故答案为:![]() ;酸性和还原性;
;酸性和还原性;
(2)因Cl2的氧化性大于I2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,可发生:Cl2+2I=I2+2Cl,I2能使淀粉变蓝;
故答案为:湿润的淀粉-KI 试纸变蓝;
(3)因Cl2的氧化性大于Br2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,可发生:Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
(4)因Cl2的氧化性大于I2的氧化性,根据氧化剂的氧化性大于氧化产物的氧化性,要发生:Cl2+2I=I2+2Cl,同时检验产物碘的存在;其操作和现象是打开活塞b,将少量C 中溶液滴入D 中,关闭活塞 b,取下D 振荡,静置后CCl4 层溶液变为紫红色,
故答案为:打开活塞b,将少量C 中溶液滴入D 中,关闭活塞 b,取下D 振荡,静置后CCl4 层溶液变为紫红色;
(5)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,
故答案为:确认C 的黄色溶液中无 Cl2,排除Cl2 对溴置换碘实验的干扰;
(6)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱,故氯、溴、碘单质的氧化性逐渐减弱;
故答案为:同主族元素从上到下,原子半径逐渐增大,得电子能力逐渐减弱。

【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)写出元素③的离子结构示意图_________,该离子半径________S2-(填“﹥”或“﹤”) ;
(2)上述元素中最高价氧化物对应的水化物的酸性最强的是(填化学式,下同)_________;
(3)上述元素中金属性最强的是_________,写出其与水反应的化学方程式____________;
(4)由④、⑧、⑩三种元素形成的简单氢化物的沸点由高到低的顺序是_______________;
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因是______(用化学方程式来表示);标况下将一装满该气体的试管倒立于水槽中,足够时间后,水面会上升到 试管容积的________处,所得试管内溶液物质的量浓度为___________mol/L(假设溶质全部留在试管中);
(6)设计实验验证比较元素③、⑦的非金属性强弱:_________。