题目内容
18.0.64g铜与一定浓度的硝酸反应,收集到标准状况下的气体224mL,被还原的硝酸的物质的量为0.1mol.分析 根据氮守恒,被还原的硝酸的物质的量等于生成气体的物质的量,由此分析解答.
解答 解:根据氮守恒,被还原的硝酸的物质的量等于生成气体的物质的量,所以被还原的硝酸的物质的量为$\frac{224mL×1{0}^{-3}L/ml}{22.4L/mol}$=0.1mol,故答案为:0.1.
点评 本题考查运用守恒的思想进行计算,注意把握硝酸的性质,解答本题的关键是把握氧化还原反应的特点,氧化剂和还原剂得失电子数目相等,答题时注意从守恒的角度入手思考.

练习册系列答案
相关题目
8.能发生消去反应,且有机产物有两种的是( )
| A. | CH3-Cl | B. | CH3CHBrCH3 | C. | CH3CH2CHBrCH3 | D. | 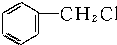 |
9.下列各组物质中,括号内为杂质,其中除杂方法不正确的是( )
| A. | Na2CO3固体(NaHCO3) 加热 | B. | I2(沙子) 加热 | ||
| C. | Na2O2(Na2O) 氧气中加热 | D. | Cl2(HCl) 通过NaOH溶液 |
13.配制100ml 0.1mol•L-1Na2CO3溶液,下列说法正确的是( )
| A. | 称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 称取1.1 g无水碳酸钠时,砝码与碳酸钠放反,所配溶液浓度偏高 | |
| C. | 转移碳酸钠溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.2mol•L-1 |
3.下列各组元素中原子序数按由小到大顺序排列的是( )
| A. | Be、C、B | B. | Li、O、Cl | C. | Al、S、Si | D. | C、S、Mg |
7.以下物质;①甲烷;②苯;③聚乙烯;④苯乙烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯.既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
| A. | ④⑤ | B. | ④⑤⑦ | C. | ③④⑤ | D. | ③④⑤⑦ |
 ;取代反应
;取代反应 ,加聚反应
,加聚反应 ;取代反应.
;取代反应.