题目内容
2.X、Y、Z、W、R属于短周期元素.已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1. 下列叙述错误的是( )| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 |
分析 X、Y、Z、W、R均为短周期元素,它们都不是稀有气体元素,X元素原子半径最大,则X为Na元素;Y 元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,则m+n=8,故Y只能有2个电子层,则n=2,故m=8-2=6,可推知Y为O元素;Z元素M层电子数=6-2=4,则Z为Si元素;W元素与Z元素同主族,可推知W为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,可知R原子核外电子数为16,则R为S元素,据此解答
解答 解:X、Y、Z、W、R均为短周期元素,它们都不是稀有气体元素,X元素原子半径最大,则X为Na元素;Y 元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,则m+n=8,故Y只能有2个电子层,则n=2,故m=8-2=6,可推知Y为O元素;Z元素M层电子数=6-2=4,则Z为Si元素;W元素与Z元素同主族,可推知W为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,可知R原子核外电子数为16,则R为S元素.
A.氧化钠与过氧化钠中阴、阳离子的个数之比均为1:2,故A正确;
B.非金属性O>S,故氢化物稳定性O>S,水分子之间存在氢键,其熔沸点高于硫化氢,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性S>C>Si,所以酸性强弱顺序为:硫酸>碳酸>硅酸,故C正确;
D.氧元素分别与硅、碳、硫元素组成的常见化合物有:二氧化硅、一氧化碳、二氧化碳、二氧化硫和三氧化硫五种,故D正确,
故选B.
点评 本题考查结构性质位置关系应用,正确推断元素是解题的关键,注意对基础知识的理解掌握,难度不大,注意元素周期律的灵活运用,知道氢键对物质物理性质的影响.

 阅读快车系列答案
阅读快车系列答案| A. | 乳酸薄荷醇酯(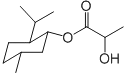 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 | |
| B. | 乙醛和丙烯醛(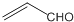 )不是同系物,它们与氢气充分反应后的产物是同系物 )不是同系物,它们与氢气充分反应后的产物是同系物 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,核磁共振氢谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用核磁共振氢谱鉴别 |
| A. | 称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 称取1.1 g无水碳酸钠时,砝码与碳酸钠放反,所配溶液浓度偏高 | |
| C. | 转移碳酸钠溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.2mol•L-1 |
| A. | 同一周期中的第ⅡA族和第ⅢA族元素的原子序数差一定为1 | |
| B. | L层上的电子数为奇数的元素一定是主族元素 | |
| C. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| D. | 族序数等于周期序数的元素一定是金属元素 |
| A. | ④⑤ | B. | ④⑤⑦ | C. | ③④⑤ | D. | ③④⑤⑦ |
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和水,甲醇和水 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(X)/(mol/L) | 0.10 | 0.10 | 0.20 |
| c(Y)/(mol/L) | 0.15 | 0.18 | 0.30 |
| A. | 反应开始时,甲中反应速率最慢,丙中反应速率最快 | |
| B. | 反应达到平衡时,甲、丙中Q的体积分数相等 | |
| C. | 乙中反应达到平衡时,X的转化率大于60% | |
| D. | 甲中反应达到平衡时,c(Y)=0.10mol/L |
 ;取代反应
;取代反应 ,加聚反应
,加聚反应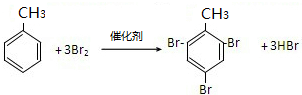 ;取代反应.
;取代反应.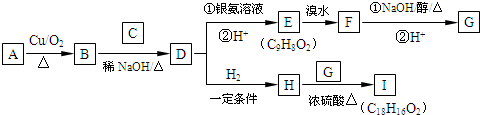
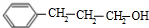 +
+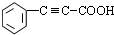 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$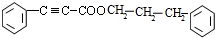 +H2O.
+H2O.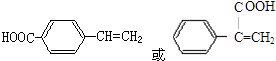 .
.