题目内容
5.写出下列物质或微粒的电子式(1)Ar
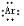
(2)CO2
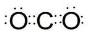
(3)KOH

(4)Na2O2

(5)H2
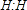
(6)N2

(7)镁离子Mg2+
(8)硫离子
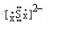 .
.
分析 (1)Ar最外层达到8个电子的稳定结构;
(2)二氧化碳中存在两个碳氧双键,C、O原子最外层都达到最外层8个电子;
(3)氢氧化钾为离子化合物,电子式需要标出阴阳离子所带电荷;
(4)Na2O2是离子化合物,由Na+离子和O2-离子构成;
(5)氢气分子中存在一个H-H共价键;
(6)氮气中存在3对共用电子对,氮原子最外层达到8个电子;
(7)金属阳离子电子式即为其离子符号;
(8)阴离子电子式需要带电荷,且带括号.
解答 解:(1)Ar最外层达到8个电子的稳定结构,故电子式为: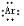 ,故答案为:
,故答案为: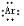 ;
;
(2)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: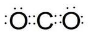 ,故答案为:
,故答案为: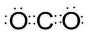 ;
;
(3)氢氧化钾为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: ,故答案为:
,故答案为: ;
;
(4)Na2O2是离子化合物,由Na+离子和O2-离子构成,Na2O2的电子式为 ,故答案为:
,故答案为: ;
;
(5)氢气分子中存在一个H-H共价键,氢气的电子式为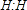 ,故答案为:
,故答案为: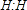 ;
;
(6)氮气中存在氮氮三键,氮气的电子式为 ,故答案为:
,故答案为: ;
;
(7)Mg2+的电子式为Mg2+; 故答案为:Mg2+;
(8)S2-电子式为: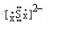 ;故答案为:
;故答案为: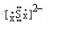 .
.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列物质一定属于同系物的是( )
①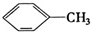 ②
②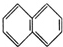 ③
③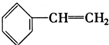 ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6
⑦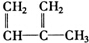 ⑧
⑧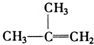
①
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
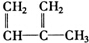 ⑧
⑧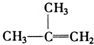
| A. | ①和 ② | B. | ④和⑥ | C. | ⑤和⑦ | D. | ⑦和⑧ |
16.下列关于各图象的解释或得出结论正确的是( )

| A. | 图1表示0.10mol•L-1NaOH溶液滴定20.00mL0.10mol•L-1醋酸溶液的滴定曲线 | |
| B. | 图2表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 根据图3所示可知:石墨比金刚石稳定 | |
| D. | 图4表示反应:2SO2+O2?2SO3,t1时刻只减小的SO3的浓度 |
13.配制100ml 0.1mol•L-1Na2CO3溶液,下列说法正确的是( )
| A. | 称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 称取1.1 g无水碳酸钠时,砝码与碳酸钠放反,所配溶液浓度偏高 | |
| C. | 转移碳酸钠溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.2mol•L-1 |
20.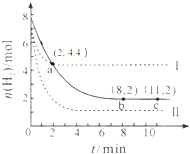 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如右图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )| A. | 曲线Ⅰ对应的条件改变可能降低温度 | |
| B. | 曲线Ⅱ对应的条件改变可能是充入氦气 | |
| C. | 该温度下,此反应的化学平衡常数的数值为0.5 | |
| D. | 从反应开始至a 点,ν(CO2)=0.6 mol•L-1•min-1 |
17.下列说法正确的是( )
| A. | 同一周期中的第ⅡA族和第ⅢA族元素的原子序数差一定为1 | |
| B. | L层上的电子数为奇数的元素一定是主族元素 | |
| C. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| D. | 族序数等于周期序数的元素一定是金属元素 |
12.在密闭容器中某气态烃和氧气按一定比例混合,点火爆炸后恢复到原温度(20℃),体积减小至原来的一半,若甲NaOH的溶液则气体全部被吸收,则此烃为( )
| A. | C2H6 | B. | C2H2 | C. | C2H4 | D. | C2H3 |
 ;取代反应
;取代反应 ,加聚反应
,加聚反应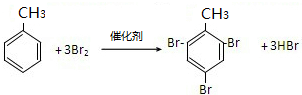 ;取代反应.
;取代反应.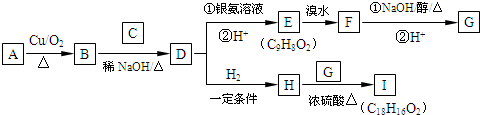
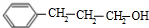 +
+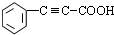 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$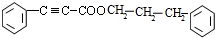 +H2O.
+H2O.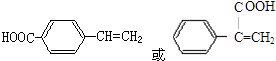 .
.