题目内容
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)  SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段 |
D
解析

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
在相同条件下(T=500K),相同体积的甲乙两容器,甲中充入1gSO2和1gO2,乙中充入2gSO2和2gO2,下列叙述中不正确的是( )
| A.反应速率:乙>甲 | B.平衡混合物中SO2的体积分数:乙>甲 |
| C.SO2的转化率:乙>甲 | D.平衡时O2的浓度:乙>甲 |
向容积相同的甲、乙密闭容器中投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g) + 3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol
2NH3(g) ΔH=-92.4 kJ·mol ):
):
| | 反应物投入量 | NH3的浓度 (mol·L  ) ) | 反应的 能量变化 | 体系压强 (Pa) | 反应物 转化率 |
| 甲 | 1mol N2、3mol H2 | c1 | 放出a kJ | p1 | α1 |
| 乙 | 2mol NH3 | c2 | 吸收b kJ | p2 | α2 |
下列说法正确的是( )
A.c1 = c2 B.a + b =" 1" C.p1>p2 D.α1 +α2>1
对于化学反应方向的确定,下列说法正确的是( )
| A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| B.温度、压强一定时,吸热的熵增反应一定能够自发进行 |
| C.反应焓变是决定反应能否自发进行的唯一因素 |
| D.固体的溶解过程与熵变无关 |
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是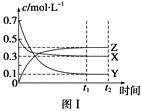
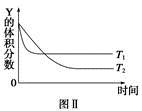
A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0 2Z(g) ΔH>0 |
| B.若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率减小 |
| C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 |
| D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
NO2和N2O4可相互转化:2NO2(g)  N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是
N2O4(g) ΔH<0现将一定量NO2和N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法中正确的是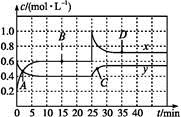
| A.图中共有两条曲线x和y,其中曲线y表示NO2浓度随时间的变化 |
| B.A、B、C、D四个点中,表示化学反应处于平衡状态的点是B和C |
| C.反应进行至25 min时,曲线发生变化的原因是加入0.4 mol N2O4 |
| D.若要达到与D相同的状态,在25 min时还可采取的措施是适当缩小容器体积 |
化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
| A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
| B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强 |
| C.向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) |
| D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大 |
在容积不变的密闭容器中存在如下反应:2A(g)+B(g) 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )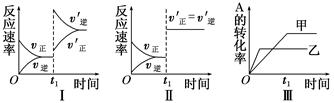
| A.图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响 |
| B.图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高 |
| D.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |