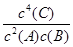题目内容
向容积相同的甲、乙密闭容器中投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g) + 3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol
2NH3(g) ΔH=-92.4 kJ·mol ):
):
| | 反应物投入量 | NH3的浓度 (mol·L  ) ) | 反应的 能量变化 | 体系压强 (Pa) | 反应物 转化率 |
| 甲 | 1mol N2、3mol H2 | c1 | 放出a kJ | p1 | α1 |
| 乙 | 2mol NH3 | c2 | 吸收b kJ | p2 | α2 |
下列说法正确的是( )
A.c1 = c2 B.a + b =" 1" C.p1>p2 D.α1 +α2>1
A
解析试题分析:甲从正反应方向开始,乙从逆反应方向开始,由于反应条件相同,容器的容积相等,物质一边倒转化后的物质的量相同,因此达到平衡时二者为等效平衡。因此达到平衡时c1 = c2。A正确。能量转化关系是a+b=92.4 kJ/mol。B错误。由于是等效平衡,所以反应达到平衡水体系的压强相等。即p1=p2 。错误。当可逆反应从正反两个相反的方向开始发生时,反应物的转化率互为倒数关系。即α1 ·α2=1。错误。
考点:考查可逆反应从正反两个相反的方向开始达到平衡时各物质的浓度、转化率、压强及能量的关系。

在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:2HI(g) I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
| A.保持容器体积不变,升高温度,混合气体的颜色逐渐变深 |
| B.恒温,恒容,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大 |
| C.恒温,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=2.5mol/L |
| D.恒温、恒压,再通入2molHI气体,到达平衡状态后,HI转化率会提高 |
在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I(aq)。测得不同温度下该反应的平衡常数K如表所示,下列说法正确的是
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1 100 | 841 | 689 | 533 | 409 |
A.反应I2(aq)+I-(aq)
 I(aq)的ΔH>0
I(aq)的ΔH>0B.其他条件不变,升高温度,溶液中c(I)减小
C.该反应的平衡常数表达式为K=
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
在一密闭容器中,反应 aA(g) bB(g)+cC(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则( )
bB(g)+cC(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则( )
| A.平衡向正反应方向移动了 | B.平衡向逆反应方向移动了 |
| C.物质B的质量分数减小了 | D.a>b+c |
在一个2L的容器中,放入2mol气体A,5分钟后,测得这种气体A还剩余0.5mol,该反应中气体A的化学反应速率是:
| A.1.5mol/(L·min) | B.0.15mol/(L·min) |
| C.0.75mol/(L·min) | D.0.075mol/(L·min) |
2010年诺贝尔化学奖化学授予理查德·赫克等三位科学家,以表彰他们在“钯催化交叉偶联”方面的研究。下面关于催化剂的说法正确的是( )
| A.催化剂只改变反应的正反应速率 |
| B.催化剂通过升高反应的活化能来加快反应速率 |
| C.催化剂能够改变反应的反应热 |
| D.催化剂不能改变反应物的转化率 |
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)  SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是( )
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段 |
在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:
2A(g)+B(g)  2C(g) ΔH>0。
2C(g) ΔH>0。
达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
| 选项 | x | y |
| A | 再通入A | B的转化率 |
| B | 加入催化剂 | A的体积分数 |
| C | 压强 | 混合气体的总物质的量 |
| D | 温度 | 混合气体的总物质的量 |
 4C(g),达平衡时c(A)=1.00mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是 ( )
4C(g),达平衡时c(A)=1.00mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是 ( )