题目内容
在某温度下,体积恒定的密闭容器中加入2 molN2和4 molH2,发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
(1)达到平衡时,N2的转化率为_______________, NH3的体积分数为 。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。a、b、c取值必须满足的一般条件是 , 。
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池总反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显 (填“酸性” 、“中性” 或“碱性” ),写出正极的电极反应方程式 。
(1)25% 20%
(2)a+c/2="2,b+3c/2=4"
(3)碱性 O2+2H2O+4e-=4OH-
解析试题分析:(1)根据化学方程式可知消耗了0.5mol的氮气,所以氮气的转化率为25%,氨气的体积分数为1/(1.5+2.5+1)=20%;
(2)等效平衡;
(3)氨气溶于水容易与酸性溶液或中性溶液中的氢离子发生化学反应。
考点:化学平衡和燃料电池。

某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度(mol·L-1) | 体积(mL) | 浓度(mol·L-1) | 体积 (mL) | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥______。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·min-1。
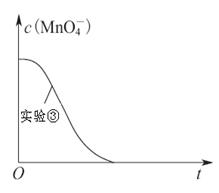
(4)已知实验③中c(MnO4-)~反应时间t的变化曲线如下图。若保持其他条件不变,请在图中画出实验②中c(MnO4-)~t的变化曲线示意图。
(7分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ/mol
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3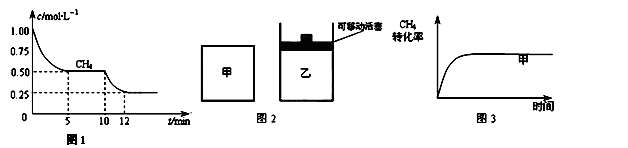
请回答下列问题:
(1)在一恒容密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内, (H2)= ;10min时,改变的外界条件可能是 .
(H2)= ;10min时,改变的外界条件可能是 .
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间变化的图象如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象
(3)反应③中△H3= .800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系式是 (填代号).
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断.
某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标况),实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 min,原因是 ;
(2)哪一段时段的反应速率最小 min,原因是 ;
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水;BNa2SO4溶液;C.NaNO3溶液;D.CuSO4溶液;E.Na2CO3溶液,你认为可行的
是 (填写字母代号)。

 b.
b. c.
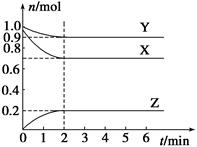
c. d.HI
d.HI 的物质的量随时间的变化如图所示。0~2min内的平均反应速率
的物质的量随时间的变化如图所示。0~2min内的平均反应速率 _________。
_________。
 b.
b. c.
c.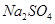 d.
d.
 Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)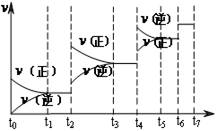
 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。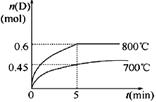
 C(g)+D(g)△H<0回答下列问题:
C(g)+D(g)△H<0回答下列问题: