题目内容
在容积为1 L的密闭容器中,进行如下反应: A(g)+2B(g) 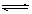 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。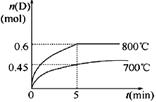
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变 B.混合气体中c(A)不变
C.v正(B)=2v逆(D) D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算800℃时的平衡常数K=___ _______,该反应为__________反应(填“吸热”或“放热”)。
(4) 800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应______ ____(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
(1)0.18 mol/(L·min) (2)ABC (3)0.9 吸热
(4)向正方向进行
解析试题分析:(1)700℃时.0-5min内,D的平均化学反应速率v(D)=△n/(V?△t)=0.45mol/(1L×5min)
=0.09mol/(L?min),同一反应中,各物质的反应速率之比等于计量数之比,所以v(B):v(D)=2:1,
故v(B)=0.18mol?L-1?min-1;
(2)该反应是反应前后气体体积减小的反应,反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;所以:
A:该反应是反应前后气体体积减小的反应,当压强不变时,各物质的浓度不再发生变化,故A正确;
B:反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,B正确;
C:v正(B)=2v逆(D),速率之比等于化学计量数之比,反应达平衡状态,故C正确;
D:无论反应是否达到平衡状态,c(A)=c(C),所以不能作为判断平衡状态的依据,故D错误;
(3) A(g)+2B(g)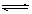 C(g)+D(g)
C(g)+D(g)
起始(mol/L) 1.0 2.2 0 0
反应(mol/L) 0.6 1.2 0.6 0.6
平衡(mol/L) 0.4 1.0 0.6 0.6
化学平衡常数K=(0.6mol/L×0.6mol/L)/[0.4mol/L×(1.0mol/L)2 ]=0.9(mol?L-1)-1;
根据图象知,降低温度D的含量减少,所以平衡向逆反应方向移动,故正反应是吸热反应。
(4)A、B、C、D各物质的浓度分别为c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,浓度商QC="(0.2" mol/L×0.018 mol/L)/[0.06 mol/L×(0.5 mol/L)2 ]=0.24(mol?L-1)-1<0.9(mol?L-1)-1,所以反应向正反应方向进行。
考点:本题考查的是化学平衡标志的判断、反应速率的计算、平衡常数的计算等。

 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
| 温度/0C | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
(1)由表中数据判断△H a 0(填“>”、“=”或“<”)。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)="0.5" mol·L-1,则此时的温度为 0C。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 浓度mol/L 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g)
 CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则w1 w2(填序号)。
A.大于 B.小于 C.等于 D.以上都有可能
Ⅱ、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式: 。
工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)  CH3OH(g)+Q
CH3OH(g)+Q
(1)能判断反应达到平衡状态的依据是(填字母序号,下同)________。
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
(3)要提高CO的转化率,可以采取的措施是________。
a.升温;b.加入催化剂;c.增加CO的浓度;d.加入H2加压;e.加入惰性气体加压;f.分离出甲醇
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。
设反应①Fe(s)+CO2(g) FeO(s)+CO(g)△H=Q1的平衡常数为K1,
FeO(s)+CO(g)△H=Q1的平衡常数为K1,
反应②Fe(s)+H2O(g) FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度(T) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可推断,反应①是________(填“放”或“吸”)热反应;
(2)现有反应③H2(g)+CO2(g)
 CO(g)+H2O(g)△H=Q3
CO(g)+H2O(g)△H=Q3①根据反应①与②推导出K1、K2、K3的关系式K3=_____________;可推断反应③是________(填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右移,可采取的措施有__________。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
D.设法减少CO的量E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3=_____________;
已知A(g)+B(g)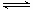 2 C(g)反应的平衡常数和温度的关系如下:
2 C(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
回答下列问题:
(1) 该反应的平衡常数表达式K=______,△H_____0(填“<”“>”“=”);
(2) 容积固定,判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.气体的密度不随时间改变 b. c(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变 d. 压强不随时间改变
(3)1200℃时反应2C(g)
 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。(4)830℃时,向一个10.00 L的密闭容器中充入0.40mol的A和1.60mol的B,如果反应初始2s内生成C的物质的量为0.40mol,则2s内A的平均反应速率v(A)= ____mol·L-1·s-1; 2s时c(B)= ____ mol·L-1; 2s时A的转化率为____;2s时C的体积分数为____。
 xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白: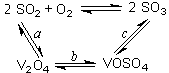
 SO3+ V2O4
SO3+ V2O4 2SO2+O2在550 ℃时的平衡常数K= 。
2SO2+O2在550 ℃时的平衡常数K= 。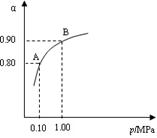
 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。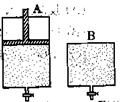
 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求: Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。