题目内容
硫一碘循环分解水制氢的主要反应如下:
(1)上述循环反应的总反应可以表示为____________________;反应过程中起催化作用的物质是__________(选填编号)。
a. b.
b. c.
c. d.HI
d.HI
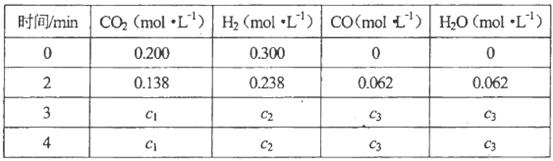
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II, 的物质的量随时间的变化如图所示。0~2min内的平均反应速率
的物质的量随时间的变化如图所示。0~2min内的平均反应速率 _________。
_________。
(3)对反应II,在相同温度和体积下,若开始加入的HI(g)的物质的量是原来的2倍,则以下_________也是原来的2倍(选填编号),
a.平衡常数 b.HI的平衡浓度
c.达到平衡时间 d.平衡时 的体积分数
的体积分数
(4)实验室用锌和稀硫酸反应制取 ,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生
,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生 的速率将增大。
的速率将增大。
a. b.
b. c.
c. d.
d.
(1)2H2O = 2H2↑+ O2↑(1分);a b (2分漏选得1分)
(2)0.05mol/(L?min) (2分)
(3)b (2分)
(4)向右 (1分),b (1分)
解析试题分析:(1)把题目所给3个化学方程式相加可得循环反应的总反应:2H2O = 2H2↑+ O2↑;SO2和I2先作为反应物参加化学反应,后面的反应又生成了SO2和I2,质量不变,所以SO2和I2为催化剂,故ab正确。
(2)根据化学方程式可知v(HI)=2v(H2)=2×0.1mol÷2L÷2min=0.05mol/(L?min)
(3)a、温度相同,平衡常数相同,错误;b、因为反应前后气体的系数相等,所以转化率相同,HI的平衡浓度为原来的2倍,正确;c、HI的物质的量增加,HI浓度增大,反应速率加快,达到平衡时间比原来缩短,错误;d、增大压强平衡不移动,平衡时H2的体积分数不变,错误。
(4)Zn和稀硫酸反应时溶液中氢离子浓度减小,水的电离平衡向右移动;
a、加入NaNO3,不产生氢气,而产生N0,、错误;b、加入CuSO4,Zn置换出Cu后形成锌铜原电池,加快反应速率,正确;c、加入Na2SO4,对反应无影响,错误;d、加入NaHCO3,则溶液中氢离子浓度减小,反应速率减慢,错误。
考点:本题考查催化剂的判断、化学方程式的判断、化学反应速率计算、化学平衡的影响因素。

某工厂以天然气、水蒸气和空气为原料和能源合成氨的流程如右图: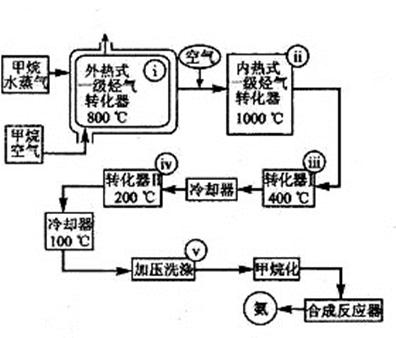
该流程中外热式一级烃转化器系指以 CH4为燃料在烃气转化器外面加热使之维持 8000C高温的工业装置。内热式一级烃气转化器系指以H2在装置内燃烧为能量维护一级烃气转化器所生成的CO与H2O(g)反应生成CO2和H2所需10000C高温的装置。在编号为i-v的反应器中发生如下反应:
| A.CH4+2O2=CO2 +2H2O | B.CH4+H2O(g)=CO +3H2 |
| C.2CH4+3H2O(g)=CO + CO2 +7H2 | D.K2CO3+CO2 +H2O=2KHCO3 |
 CO2 + H2ΔH<0 F.2H2 +O2=2H2O
CO2 + H2ΔH<0 F.2H2 +O2=2H2O(1)反应A发生在编号为______的反应器中,它的作用是_______________________________。
(2)反应F发生在编号为____________的反应器中。
(3)反应D的作用是____________。
(4)属于制备合成氨原料气的反应有______(填化学方程式编号)。
(5)为什么转化反应要分两步——第一步在4000C时进行,第二步在200 0C时进行?
________________________________________________________________________________。
甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
| 温度/0C | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
(1)由表中数据判断△H a 0(填“>”、“=”或“<”)。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)="0.5" mol·L-1,则此时的温度为 0C。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 浓度mol/L 时间/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①反应从2 min到4 min之间,H2的反应速率为 。
②反应达到平衡时CO的转化率为 。
③反应在第2 min时改变了反应条件,改变的条件可能是 (填序号)。
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g)
 CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则w1 w2(填序号)。
A.大于 B.小于 C.等于 D.以上都有可能
Ⅱ、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式: 。
在80℃时,将0.40mo1的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4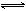 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| t/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)计算在80℃时该反应的平衡常数K= (请注明单位)。
(3)反应进行至100s后将反应混合物的温度升高,混合气体的颜色 (填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有 (填序号)。
A.增大N2O4的起始浓度
C.使用高效催化剂
B.向混合气体中通入NO2
D.升高温度
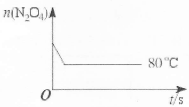
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出(不用计算,定性处理)该反应在60℃时N2O4物质的量的变化曲线。
(1)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率 (填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
| 浓度 物质 | CO | H2O | CO2 | H2 |
| 起始浓度/(mol·L-1) | 2.0 | x | 0 | 0 |
| 平衡浓度/(mol·L-1) | 0.4 | 6.4 | 1.6 | 1.6 |
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
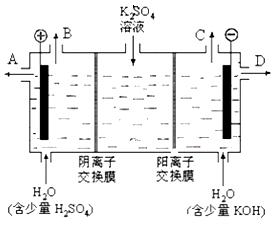
①该电解槽的阳极反应式为 。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为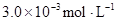 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 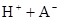 | 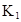 | 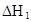 | 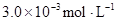 |
在苯中,2HA 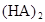 | 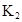 | 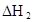 | 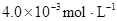 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则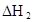 ___________0。
___________0。(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足
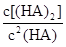 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。  其平衡常数K和温度,的关系如下:
其平衡常数K和温度,的关系如下:
 B.混合气体中CO浓度不变
B.混合气体中CO浓度不变
 H2(g)+
H2(g)+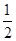 S2(g)
S2(g)
 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求: