题目内容
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)  Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)该反应的氧化剂是 ,2molN2参加反应转移电子数为 ;
(2)该反应的平衡常数表达式为K= ;
(3)若CO的生成速率为v(CO)=18mol·L-1·min-1,则N2的消耗速率为v(N2)=
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中CO的含量最高的一段时间是 。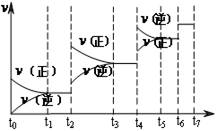
(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是 (提示:272 = 729)
(1)氮气 (1分) 12NA (1分)(2)K=[c(CO)]6/[c(N2)]2 (2分)(3)6 mol?L-1?min-1 (1分) (4)升高温度或增大压强(2分) t3~t4(2分) (5)50%(2分)
解析试题分析:(1)反应中N元素的化合价降低,有0价降为-3价,则氧化剂为氮气,氧化剂对应的生成物为还原产物,应为氮化硅,故答案为:氮气;氮化硅;(2)平衡常数等于气体生成物的浓度幂之积除以气体反应物的浓度幂之积,则K=[c(CO)]6/[c(N2)]2(3)反应放热,△H<0,升高温度平衡移动逆反应方向移动,平衡常数减小,速率之比等于化学计量数之比,则v(N2)=1/3×v(CO)=1/3×18mol?L-1?min?1="6" mol?L-1?min?1(4) t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强,在t4时反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高,故答案为:升高温度或增大压强,t3~t4;
(5)设反应的N2的物质的量为x,
3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
起始: 2mol 0
转化: x 3x
平衡: 2-x 3x
则平衡时N2的浓度为(2-x)mol/L,CO的浓度为3x mol/L,则有:(3x)6/(2-x)2=729,解之得x=1,则N2的转化率是50%。
考点:化学平衡的计算;氧化还原反应;吸热反应和放热反应;反应速率的定量表示方法;化学平衡常数的含义;化学平衡的影响因素 。

(1)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率 (填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是 (填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
| 浓度 物质 | CO | H2O | CO2 | H2 |
| 起始浓度/(mol·L-1) | 2.0 | x | 0 | 0 |
| 平衡浓度/(mol·L-1) | 0.4 | 6.4 | 1.6 | 1.6 |
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
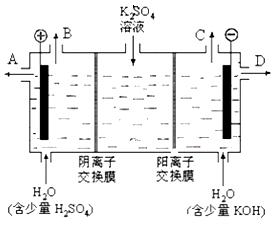
①该电解槽的阳极反应式为 。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为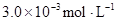 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 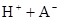 | 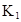 | 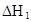 | 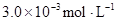 |
在苯中,2HA 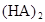 | 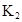 | 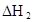 | 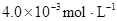 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则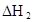 ___________0。
___________0。(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足
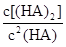 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。 工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)  CH3OH(g)+Q
CH3OH(g)+Q
(1)能判断反应达到平衡状态的依据是(填字母序号,下同)________。
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
(3)要提高CO的转化率,可以采取的措施是________。
a.升温;b.加入催化剂;c.增加CO的浓度;d.加入H2加压;e.加入惰性气体加压;f.分离出甲醇
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为放热反应,理由是 。
② 理论上,为了增大平衡时H2的转化率,可采取的措施是 。(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g) + H2O (g)
 CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g) + 3H2(g) 获取,已知该反应中,当初始混合气中的 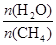 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: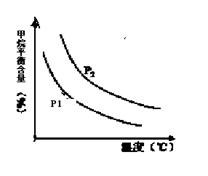
①图中,两条曲线表示压强的关系是:P1 P2(填“>”、“=”或“<”)。
②该反应为 反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g) + H2O(g)
 CO2 (g) + H2(g) 获取。
CO2 (g) + H2(g) 获取。①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2)=1 : 16 : 6 : 6
 H2(g)+
H2(g)+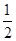 S2(g)
S2(g)
 xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白: 2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求:
2NH3(g);ΔH=—92.4 kJ/mol。达到平衡时,放出热量46.2 kJ。求: xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)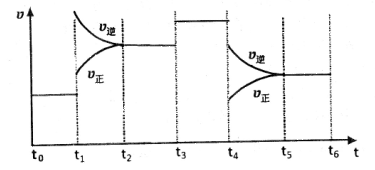
 、
、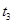 、
、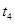 时刻体系中分别是什么条件发生了变化?
时刻体系中分别是什么条件发生了变化?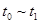 B.
B.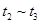 C.
C.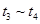 D.
D.