��Ŀ����
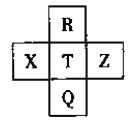
����Ŀ��A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������A������������Ԫ�طֱ��γɶ�Ԫ���������ֻ����D�γɵĻ������г�-1�ۣ�B2C5��Ӧ��ˮ������BA3��Ӧ����һ����X��D��ԭ�Ӱ뾶�ڶ����������0��Ԫ�س���)��EԪ��ԭ�ӵ���������������������������3/4������ش��������⣺
(1) X�Ļ�ѧʽΪ_____��������DA�ĵ���ʽΪ________��
(2)Ԫ�صķǽ����� C____________ E(�������� ��<������=�������и����У���˵���ý��۵���ʵ��_______��(�����)��
���⻯��H2E�����Ա�H2Cǿ
���⻯��H2C�����ȶ��Ա�H2Eǿ
���⻯��H2E��ˮ��Һ�����ڿ����л�����
�ܵ�������������C��E����
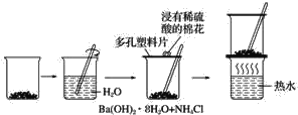
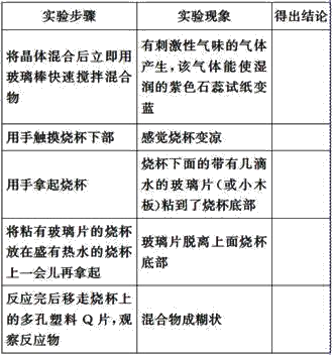
(3)ʵ���ҽ�BC��BC2��ɵĻ������ͨ����ͼ��ʾװ���У�������֤Ũ����� �����Ա�ϡ�����������ǿ��
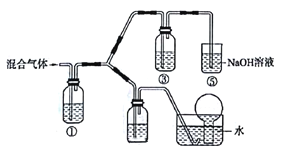
��֪����i��Ũ�����ܽ�����BC������BC2,��ϡ���������BC��
��ii��NaOH��Һ��BC2����ȫ��Ӧ����BC���岻��Ӧ��
a.װ�â١��ڡ�����ʢ�ŵ�ҩƷ��������___________��_______________��______________ ��
b.ͨ��������֮ǰ��Ӧ��ͨ��һ��ʱ��ij����һ�����壬���Ʋ���ͨ��ĸ����������___________(��һ������Ļ�ѧʽ����
c.�ܹ�˵��ʵ���ѳɹ���������________ ��
���𰸡� NH4NO3 ![]() > �ڢۢ� H2O ϡ���� Ũ���� CO2��N2��H2�Ⱥ����𰸾��ɣ� ����������Ȼ��ɫ��������ɫ�����Ϊ����ɫ
> �ڢۢ� H2O ϡ���� Ũ���� CO2��N2��H2�Ⱥ����𰸾��ɣ� ����������Ȼ��ɫ��������ɫ�����Ϊ����ɫ
�����������������A������������Ԫ�طֱ��γɶ�Ԫ���������ֻ����D�γɵĻ������г�-1�ۣ�D��ԭ�Ӱ뾶�ڶ����������D��Na��A��H��B2C5��Ӧ��ˮ������BA3��Ӧ����һ����X��B��N��C��O��X��NH4NO3��EԪ��ԭ�ӵ���������������������������3/4����E��S��
�������������Ϸ�����(1) X�Ļ�ѧʽΪNH4NO3��������NaH�����ӻ��������ʽΪ![]() ��
��
(2)ͬ����Ԫ�ش��ϵ��·ǽ����Լ�����Ԫ�صķǽ�����O> S��
���⻯������Բ��ܱȽϷǽ����Ե�ǿ�����ʢٴ���
���ǽ�����Խǿ���⻯��Խ�ȶ����⻯��H2O�����ȶ��Ա�H2Sǿ���ʢ���ȷ��
���⻯��H2S��ˮ��Һ�����ڿ����л�������˵�����������Դ���S���ʢ���ȷ��
���ǽ�����Խǿ��Խ�����������ϣ���������������O��S���ף�������ȷ��
(3) a.����ʵ��Ŀ�ģ�װ�â�����ˮ��ȥNO�е�NO2��װ����������ˮ���ռ����壬��֪װ����û�а�NO����ΪNO2����������ʢ��ϡ������װ�����������������������壬��֪װ�â۰�NO����ΪNO2�����Ԣ���ʢ��Ũ������
b.Ϊ��ֹ��������NO��ͨ��������֮ǰ��Ӧ��ͨ��һ��ʱ��ij����һ�����壬������ͨ��ĸ����������CO2��N2��H2����
c. ����������Ȼ��ɫ��������ɫ�����Ϊ����ɫ�ܹ�˵��ʵ���ѳɹ���

 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�����Ŀ���������ʵ����ѡ���װ�û�����(�г�װ������ȥ)��ȷ���ǣ� ��
A | B | C | D | |
ʵ�� | ��ȡ����������CO2���� | ��CCl4��ȡ��ˮ�е�Br2 | ��ȥCO2��������HCl | ����NaCl������Һ�Ʊ�NaCl���� |
װ�û����� |
|
|
|
|
A.AB.BC.CD.D