题目内容
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:
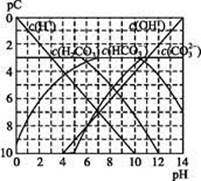
(1)在人体血液中,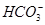 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
②正常人体血液中,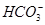 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c(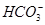 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值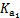 ≈ 。
≈ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C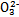 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)="0.15" mol·L-1.c(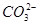 )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。

(1)在人体血液中,
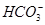 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。 ②正常人体血液中,
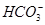 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。 ③pH=7.00的血液中,c(H2CO3) c(
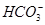 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。 (2)H2CO3一级电离平衡常数的数值
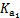 ≈ 。
≈ 。 (3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C
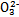 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。 (4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)="0.15" mol·L-1.c(
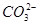 )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。(1)①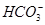
 H++
H++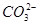 .
.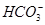 +H2O
+H2O H2CO3+OH- ②> ③<
H2CO3+OH- ②> ③<
(2)1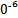
(3)用pH试纸(或pH计)测常温下0.1 mol·L-1 Na2CO3溶液的pH,若pH<12,该同学的观点正确;若pH>12,则该同学的观点错误
(4)c(Li+)="0.075" mol·L-1.c(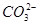 )="0.1" mol·L-1,
)="0.1" mol·L-1,
c2(Li+)·c(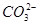 )=5.6×1
)=5.6×1 <1.68×10-3,所以无沉淀产生。
<1.68×10-3,所以无沉淀产生。
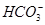
 H++
H++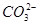 .
.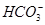 +H2O
+H2O H2CO3+OH- ②> ③<
H2CO3+OH- ②> ③<(2)1
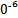
(3)用pH试纸(或pH计)测常温下0.1 mol·L-1 Na2CO3溶液的pH,若pH<12,该同学的观点正确;若pH>12,则该同学的观点错误
(4)c(Li+)="0.075" mol·L-1.c(
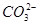 )="0.1" mol·L-1,
)="0.1" mol·L-1,c2(Li+)·c(
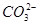 )=5.6×1
)=5.6×1 <1.68×10-3,所以无沉淀产生。
<1.68×10-3,所以无沉淀产生。(1)①依据信息抓住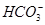 既能水解也能电离分析;②由信息可知正常人体血液显碱性,所以水解大于电离;③由图像可知c(H2CO3)=c(
既能水解也能电离分析;②由信息可知正常人体血液显碱性,所以水解大于电离;③由图像可知c(H2CO3)=c(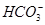 )时溶液显酸性,显中性时c(
)时溶液显酸性,显中性时c(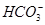 )>c(H2CO3);(2)
)>c(H2CO3);(2)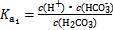 ,pH=6时c(H2CO3)=c(
,pH=6时c(H2CO3)=c(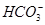 ),所以
),所以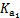 =c(H+);(3)由
=c(H+);(3)由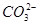 +H2O
+H2O
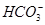 +OH-可知测一定浓度的Na2CO3溶液中c(OH-)即可求出已水解的Na2CO3的浓度;(4)注意最后溶液的体积为原体积的2倍。
+OH-可知测一定浓度的Na2CO3溶液中c(OH-)即可求出已水解的Na2CO3的浓度;(4)注意最后溶液的体积为原体积的2倍。
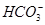 既能水解也能电离分析;②由信息可知正常人体血液显碱性,所以水解大于电离;③由图像可知c(H2CO3)=c(
既能水解也能电离分析;②由信息可知正常人体血液显碱性,所以水解大于电离;③由图像可知c(H2CO3)=c(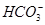 )时溶液显酸性,显中性时c(
)时溶液显酸性,显中性时c(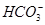 )>c(H2CO3);(2)
)>c(H2CO3);(2)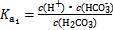 ,pH=6时c(H2CO3)=c(
,pH=6时c(H2CO3)=c(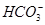 ),所以
),所以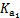 =c(H+);(3)由
=c(H+);(3)由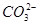 +H2O
+H2O
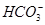 +OH-可知测一定浓度的Na2CO3溶液中c(OH-)即可求出已水解的Na2CO3的浓度;(4)注意最后溶液的体积为原体积的2倍。
+OH-可知测一定浓度的Na2CO3溶液中c(OH-)即可求出已水解的Na2CO3的浓度;(4)注意最后溶液的体积为原体积的2倍。
练习册系列答案
相关题目
 、
、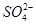 、Cl-、I-、
、Cl-、I-、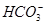 ,取该溶液进行如下实验:
,取该溶液进行如下实验: )>c(OH-)>c(H+)
)>c(OH-)>c(H+)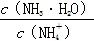 值变小
值变小 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)