题目内容
关于10 mL 0.1 mol·L-1的NH3·H2O溶液,下列说法正确的是
| A.25 ℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10-6 mol·L-1 |
B.向溶液中加入少量CH3COONa固体,溶液中的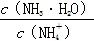 值变小 值变小 |
C.向溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液中离子浓度大小顺序为c(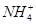 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
D.向溶液中加入5 mL 0.1 mol·L-1 HCl,所得溶液中离子的浓度一定符合:c(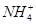 )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
D
A项,氨水中存在平衡NH3·H2O
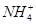 +OH-,若pH=11,则c(
+OH-,若pH=11,则c(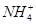 )=c(OH-)=1.0×10-3mol·L-1,则Kb(NH3·H2O)= mol·L-1=1×10-5 mol·L-1;B项,加入CH3COONa固体抑制氨水的电离,即氨水的电离平衡左移,溶液中的
)=c(OH-)=1.0×10-3mol·L-1,则Kb(NH3·H2O)= mol·L-1=1×10-5 mol·L-1;B项,加入CH3COONa固体抑制氨水的电离,即氨水的电离平衡左移,溶液中的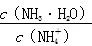 值变大;溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液为NH4Cl溶液,由于
值变大;溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液为NH4Cl溶液,由于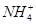 的水解,c(Cl-)>c(
的水解,c(Cl-)>c(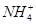 ),溶液显酸性,C项错误;根据溶液的电中性,D项正确。
),溶液显酸性,C项错误;根据溶液的电中性,D项正确。

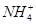 +OH-,若pH=11,则c(
+OH-,若pH=11,则c(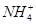 )=c(OH-)=1.0×10-3mol·L-1,则Kb(NH3·H2O)= mol·L-1=1×10-5 mol·L-1;B项,加入CH3COONa固体抑制氨水的电离,即氨水的电离平衡左移,溶液中的
)=c(OH-)=1.0×10-3mol·L-1,则Kb(NH3·H2O)= mol·L-1=1×10-5 mol·L-1;B项,加入CH3COONa固体抑制氨水的电离,即氨水的电离平衡左移,溶液中的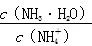 值变大;溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液为NH4Cl溶液,由于
值变大;溶液中加入10 mL 0.1 mol·L-1 HCl,所得溶液为NH4Cl溶液,由于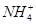 的水解,c(Cl-)>c(
的水解,c(Cl-)>c(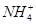 ),溶液显酸性,C项错误;根据溶液的电中性,D项正确。
),溶液显酸性,C项错误;根据溶液的电中性,D项正确。
练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
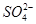
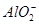 、
、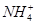 、Na+、
、Na+、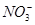
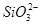
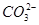 )>c(
)>c(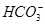 )
)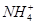 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)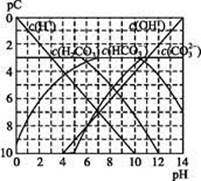
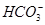 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。 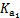 ≈ 。
≈ 。 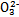 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确。 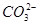 )="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)="0.075" mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。