题目内容
19.已知在448℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数为49,求下列化学方程式在该温度下的平衡常数.(1)2HI(g)?H2(g)+I2(g);
(2)$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)?HI(g);
(3)2H2(g)+2I2(g)?4HI(g).
分析 平衡常数为生成物浓度幂之积与反应物浓度幂之积的比,互为逆反应的平衡常数互为倒数,化学计量数为倍数关系时平衡常数为平方关系;
解答 解:448℃时,反应H2(g)+I2(g)?2HI(g)的平衡常数K1为49,
则温度下反应2HI(g)?H2(g)+I2(g)的平衡常数K2为$\frac{1}{{K}_{1}}$=$\frac{1}{49}$,
反应$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)?HI(g)的平衡常数K3为$\sqrt{{K}_{1}}$=$\sqrt{49}$=7,
反应2H2(g)+2I2(g)?4HI(g)的平衡常数K4为K12=492=2401
故答案为:$\frac{1}{49}$;7;2401;
点评 本题考查化学平衡的计算,明确平衡常数的计算方法及平衡常数与反应方程式的关系,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列有机化合物分子中的所有碳原子不可能处于同一平面的是( )
| A. | HC≡C-CH3 | B. | 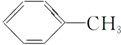 | C. | 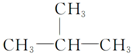 | D. | 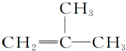 |
10.下列叙述中,正确的是( )
| A. | 不同的原子之间只能构成共价化合物 | |
| B. | 单质中不一定存在非极性键 | |
| C. | 非金属原子之间只能构成共价化合物 | |
| D. | Cl2的沸点比F2高,这与化学建的大小有关 |
7.下列化合物中,含有非极性键的离子化合物是( )
| A. | Ba(OH)2 | B. | H2O2 | C. | Na2O2 | D. | CaCl2 |
14.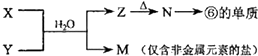 下表是元素周期表的一部分,请用化学用语回答有关问题
下表是元素周期表的一部分,请用化学用语回答有关问题
(1)写出相应的元素符号:②N ④F ⑤Na ⑧S
(2)表中最不活泼元素,其原子结构示意图为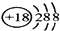
(3)表中最高价氧化物对应的水化物碱性最强的物质是NaOH,酸性最强的物质是HClO4.
(4)④、⑤、⑥元素的离子半径由大到小的顺序是F->Na+>Al3+,④、⑧、⑨简单阴离子的还原性由大到小的顺序是S2->Cl->F-.
(5)由表中元素形成的物质X、Y、Z、M、N可发生以图反应:X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
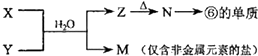 下表是元素周期表的一部分,请用化学用语回答有关问题
下表是元素周期表的一部分,请用化学用语回答有关问题 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)表中最不活泼元素,其原子结构示意图为
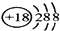
(3)表中最高价氧化物对应的水化物碱性最强的物质是NaOH,酸性最强的物质是HClO4.
(4)④、⑤、⑥元素的离子半径由大到小的顺序是F->Na+>Al3+,④、⑧、⑨简单阴离子的还原性由大到小的顺序是S2->Cl->F-.
(5)由表中元素形成的物质X、Y、Z、M、N可发生以图反应:X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
16.根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
N2(g)+3H2 (g)=2NH3(g)△H=-92.38kJ•mol-1
H2(g)+Cl2(g)=2HCl(g)△H=-184.72kJ•mol-1
I2(g)+H2(g)=2HI(g)△H=+51.92kJ•mol-1.
N2(g)+3H2 (g)=2NH3(g)△H=-92.38kJ•mol-1
H2(g)+Cl2(g)=2HCl(g)△H=-184.72kJ•mol-1
I2(g)+H2(g)=2HI(g)△H=+51.92kJ•mol-1.
| A. | HI>HCl>NH3 | B. | HCl>NH3>HI | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
 .
. 