题目内容
14.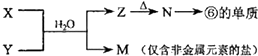 下表是元素周期表的一部分,请用化学用语回答有关问题
下表是元素周期表的一部分,请用化学用语回答有关问题 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)表中最不活泼元素,其原子结构示意图为
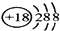
(3)表中最高价氧化物对应的水化物碱性最强的物质是NaOH,酸性最强的物质是HClO4.
(4)④、⑤、⑥元素的离子半径由大到小的顺序是F->Na+>Al3+,④、⑧、⑨简单阴离子的还原性由大到小的顺序是S2->Cl->F-.
(5)由表中元素形成的物质X、Y、Z、M、N可发生以图反应:X溶液与Y溶液反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
分析 根据元素在周期表中的分布,可以知道①是H,②是N,③是O,④是F,⑤是Na,⑥是Mg,⑦是Al,⑧是S,⑨是Cl,⑩是Ar,
(1)依据分析书写即可;
(2)稀有气体最外层达到了稳定结构,最不活泼;
(3)元素的金属性越强,其对应最高价氧化物的水化物的碱性越强,元素的非金属性越强,其最高价氧化物的水化物的酸性越强;
(4)电子层越多半径越大,电子层一样多的原子,核电荷数越多半径越小;
(5)M是仅含非金属的盐所以一定是铵盐;Z$\stackrel{△}{→}$N→⑥的单质.根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知XY是铝盐和一水合氨的反应.
解答 解:根据元素在周期表中的分布,①是H,②是N,③是O,④是F,⑤是Na,⑥是Mg,⑦是Al,⑧是S,⑨是Cl,⑩是Ar,
(1)②、④、⑤、⑧分别是N、F、Na、S,故答案为:N、F、Na、S;
(2)所有这些所给的元素里,0族的氩最外层达到了8个电子的稳定结构,最不活泼,原子结构示意图为: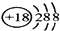 ,故答案为:
,故答案为: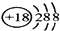 ;
;
(3)由于所给堵塞元素中Na的金属性最强,故NaOH的碱性最强,由于F为含氧酸,故除F外Cl的非金属性最强,故高氯酸的酸性最强,故答案为:NaOH;HClO4;
(4)电子层一样多的原子,核电荷数越多半径越小,F-、Na+、Al3+均为10电子离子,即F->Na+>Al3+,S2-和Cl->均为18电子阴离子,故S2->Cl-,F-为2个电子层,故半径小于Cl-,即S2->Cl->F-,故答案为:F->Na+>Al3+;S2->Cl->F-;
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生如图转化的反应,其中M是仅含非金属的盐,所以一定是铵盐;Z$\stackrel{△}{→}$N→⑥的单质;根据周期表的结构判断⑥是金属铝,所以推断N是氧化铝电解生成金属铝,Z是氢氧化铝受热分解生成氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+可知XY是铝盐和一水合氨的反应;所以X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+.
点评 本题考查了元素周期表与元素周期律的综合应用,题目难度中等,注意掌握元素周期律内容、元素周期表结构,试题培养学生灵活应用基础知识的能力.

| A. | 氢键是一种较弱的化学键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 常温下,Cl2、Br2、I2的状态从气态、液态到固态,主要原因是分子间作用力在逐渐增大 | |
| D. | 最外层能达到稳定结构的微粒只是稀有气体的原子 |
| A. | 18 | B. | 16 | C. | 8 | D. | 6 |

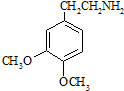 .
.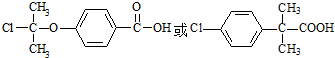 .
. (R、R′为烃基).根据已有知识并结合相关信息,写出以乙醇为原料制备
(R、R′为烃基).根据已有知识并结合相关信息,写出以乙醇为原料制备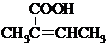 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: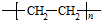

 .
. +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$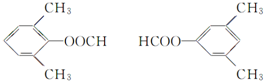 .
.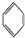 、④HCHO,其中碳原子采取sp2杂化的分子有①③④
、④HCHO,其中碳原子采取sp2杂化的分子有①③④