题目内容
4.含硫元素的化合物很多,在工业上的应用也很广泛.回答下列问题:(1)硫在元素周期表中的位置为第三周期第ⅥA族.已知氢硫酸是二元弱酸,写出其电离方程式:H2S?H++HS-、HS-?H++S2-.
(2)乙硫醇(C2H5SH)俗称煤气的“报警器”,有强烈的蒜气味,具有可燃性.乙硫醇中硫元素的化合价为-2,在空气中充分燃烧的化学方程式是2C2H5SH+9O2 $\frac{\underline{\;点燃\;}}{\;}$4CO2+2SO2+6H2O.
(3)硫代硫酸钠(Na2S2O3)具有很强的还原性,在溶液中易被Cl2氧化,常用作脱氯剂,该反应的离子方程式为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+.
(4)连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,可用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,则每消耗0.1mol保险粉,理论上可以除去Cr2O72-的物质的量为0.1mol.
(5)由硫和钠反应可制得多硫化钠Na2Sx,x的值一般为2~6.
①但x=2时,称为过硫化钠,过硫化钠加入盐酸中有硫沉淀析出,该反应中氧化产物与还原产物的物质的量之比为1:1;
②钠硫高能电池的工作温度为200℃左右,电池反应为2Na+xS═Na2Sx,正极的电极反应式为xS+2e-=Sx2-(或2Na++xS+2e-=Na2Sx),与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池4.5倍.
分析 (1)依据硫原子结构判断周期表中的位置,硫化氢是二元弱酸存在两步电离;
(2)乙硫醇(C2H5SH)中硫元素化合价类似于乙醇中的氧元素,化合价为-2价,充分燃烧生成二氧化碳、二氧化硫和水;
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,则氯气被还原为氯离子;
(4)依据连二亚硫酸钠(Na2S2O4)被重铬酸根离子(Cr2O72-被转化为Cr3+)氧化为硫酸根离子的反应定量关系计算分析;
(5)①过硫化钠加入盐酸中有硫沉淀析出,Na2S2中硫元素为-1价,生成S沉淀为0价,所以还生成硫元素为-2价的H2S,元素化合价升高的得到氧化产物,元素化合价降低的得到还原产物;
②原电池正极发生得电子的还原反应,结合原电池的构成条件和题意实际情况来分析M的作用,根据铅蓄电池的工作原理和钠硫高能电池的工作原理和电子守恒计算来回答;
解答 解:(1)由硫原子结构中有三个电子层,最外层6个电子,则位于周期表中第三周期ⅥA族,硫化氢是二元弱酸存在两步电离,电离方程式为:H2S?H++HS-、HS-?H++S2-;
故答案为:第三周期ⅥA族;H2S?H++HS-、HS-?H++S2-;
(2)乙硫醇(C2H5SH)中硫元素化合价类似于乙醇中的氧元素,化合价为-2价,充分燃烧生成二氧化碳、二氧化硫和水,反应的化学方程式2C2H5SH+9O2 $\frac{\underline{\;点燃\;}}{\;}$4CO2+2SO2+6H2O;
故答案为:-2;2C2H5SH+9O2 $\frac{\underline{\;点燃\;}}{\;}$4CO2+2SO2+6H2O;
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,则氯气被还原为氯离子,离子反应为S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+;
故答案为:S2O32-+4Cl2+5H2O═2SO42-+8Cl-+10H+;
(4)连二亚硫酸钠(Na2S2O4)被重铬酸根离子(Cr2O72-被转化为Cr3+)氧化为硫酸根离子,除去废水中的重铬酸根离子时保险粉作还原剂,被氧化为SO42-,每摩尔保险粉失6mol电子,而每摩尔Cr2O72-得6mol电子,所以每消耗0.1mol保险粉,理论上可以除去Cr2O72-的物质的量为0.1mol;
故答案为:0.1;
(5)①过硫化钠加入盐酸中有硫沉淀析出,Na2S2中硫元素为-1价,生成S沉淀为0价,所以还生成硫元素为-2价的H2S,则反应方程式为:Na2S2+2HCl=2NaCl+H2S↑+S↓,Na2S2中硫元素为-1价,降低到-2价,被还原,所以还原产物为H2S,反应中氧化产物与还原产物的物质的量之比1:1;
故答案为:1:1;
②正极上硫得电子发生还原反应,所以正极电极反应式为:xS+2e-═Sx2-,熔融状态下,Na2O和Al2O3能电离出阴阳离子而使电解质导电,且钠易和硫反应,所以它起到离子导电和隔离作用,钠高能电池中负极为钠,有23g钠消耗释放1mol e-,则207g钠消耗时转移$\frac{207}{23}$mol e-,铅蓄电池的电极反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,铅蓄电池中铅是负极,207g铅消耗时转移 2mol e-,故钠硫电池的理论放电量是铅蓄电池的:207÷23÷2=4.5 倍,
故答案为:xS+2e-=Sx2-(或2Na++xS+2e-=Na2Sx);离子导电(导电或电解质)和隔离钠与硫;4.5.
点评 本题考查了硫及其化合物性质的分析判断,离子方程式的书写方法,氧化还原反应计算应用,原电池原理的理解应用,掌握基础是关键,题目难度中等.

| A. | 3:1 | B. | 1:3 | C. | 2:1 | D. | 1:2 |
| 元素 | a | b | c | d | e |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 元素a、c、d的最高价氧化物都属于酸性氧化物 | |
| B. | 元素c、d、e的氢化物稳定性和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 元素周期表中,元素c位于金属和非金属分界线附近,其单质常用作光电池材料 | |
| D. | 元素b、d、e的原子半径和离子半径均依次减小 |
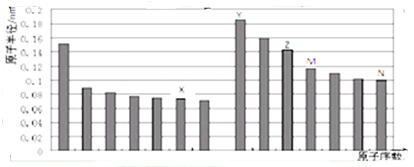
| A. | 金属性:Z>Y | |
| B. | 气态氢化物的稳定性:M>N | |
| C. | X和Y形成的化合物中可能含共价键 | |
| D. | Z元素的离子半径是本周期元素离子半径最小的 |
| A. | 溴苯 | B. | 对二甲苯 | C. | 乙烷 | D. | 丙烯 |
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应.
①铁锈与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
②“还发生另一个反应”对应的离子方程式应为Fe+2Fe3+=3Fe2+.
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中.
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,依次滴入适量的氯水和几滴KSCN溶液,振荡. | 溶液呈血红色 | 乙同学的观点正确 (填“正确”或“错误”). |
| A. | 2 min末时A和B的浓度之比为5:3 | |
| B. | x=1 | |
| C. | 2 min末时B的浓度为1.5 mol•L-1 | |
| D. | 前2 min,A的消耗浓度为0.5 mol•L-1 |