题目内容
13.两种有机物以一定比例混合,一定条件下在a L O2(足量)中燃烧,充分反应后恢复到原状态,再通过足量Na2O2层,得到气体仍是a L,下列混合有机物中符合此条件的是( )| A. | CH4、C2H4 | B. | CH3OH、CH3COOH | C. | C2H6、HCHO | D. | HCHO、CH3COOCH3 |
分析 设有机物的平均分子式为CxHyOz,则1mol混合物消耗氧气的物质的量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,生成xmolCO2,$\frac{y}{2}$molH2O,与过氧化钠反应生成氧气共为:$\frac{1}{2}$×(x+$\frac{y}{2}$)mol,由题意可知,(x+$\frac{y}{4}$-$\frac{z}{2}$)mol=$\frac{1}{2}$×(x+$\frac{y}{2}$)mol,以此解答.
解答 解:由题意可知,消耗的氧气等于生成的氧气,
设有机物的平均分子式为CxHyOz,则1mol混合物消耗氧气的物质的量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,生成xmolCO2,$\frac{y}{2}$molH2O,与过氧化钠反应生成氧气共为:$\frac{1}{2}$×(x+$\frac{y}{2}$)mol,由题意可知,有机物燃烧消耗的氧气的物质的量一定等于过氧化钠与二氧化碳、水反应放出氧气的物质的量,
即:(x+$\frac{y}{4}$-$\frac{z}{2}$)mol=$\frac{1}{2}$×(x+$\frac{y}{2}$)mol,解得:x=z,则混合物分子中碳原子数与氧原子数相等,
A.CH4 C2H4:二者不含氧原子,不满足题意,故A错误;
B.CH3OH CH3COOH:两种有机物分子中碳原子数与氧原子数相等,满足条件,故B正确;
C.C2H6 HCHO:二者的混合物中,无论以任意比例混合都无法满足碳原子数与氧原子数相等,故C错误;
D.HCHO、CH3COOCH3:二者无论怎样混合,碳原子数与氧原子数都不会相等,故D错误;
故选B.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握题给信息,结合方程式解答该题,难度中等.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )
石墨是层状晶体,每一层内碳原子结构如图所示,如果将相邻两个碳原子间的化学键看成是一个化学键,则石墨晶体每一层内碳原子数与C-C化学键数目之比是( )| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:3 |
| A. | CO2 | B. | CH4 | C. | NH4NO3 | D. | HCl |
| A. | 用1L水里含有溶质物质的量来表示的浓度叫做物质的量浓度 | |
| B. | 用一定量溶液里含有溶质的多少来表示的浓度叫做物质的量浓度 | |
| C. | 用1L溶液里含有溶质的量来表示的浓度叫做物质的量浓度 | |
| D. | 用1L溶液里含有多少摩尔溶质来表示的浓度叫做物质的量浓度 |
| A. | $\frac{adω}{24}$mol | B. | $\frac{dω}{24a}$mol | C. | $\frac{adω}{22400}$mol | D. | $\frac{adω}{12}$mol |
| A. | 当a=b>0时,该反应达到化学平衡状态 | |
| B. | 该反应达到化学平衡状态时,一定有a>b | |
| C. | 当密闭容器内气体密度不再改变时,该反应达到化学平衡状态 | |
| D. | 密闭容器中X和Y的物质的量之比为1:2时,该反应达到化学平衡状态 |
| A. | 碳棒上有气体放出,溶液pH变大 | B. | a是正极,b是负极 | ||
| C. | 电子从a极流向b极 | D. | a极上发生了氧化反应 |
| A. | H2O | B. | Na2O | C. | K2S | D. | Na2S |
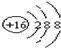 ,Br -的电子式:
,Br -的电子式: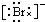 ,CO2的结构式:O=C=O
,CO2的结构式:O=C=O
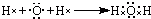 .
.