题目内容
18.常温下,碱性溶液中,可能大量共存的离子组是( )| A. | K+、CO32-、Cl-、NO3- | B. | K+、Fe2+、I-、SO42- | ||
| C. | Ba2+、Na+、Cl-、NO3- | D. | Na+、Ca2+、Al3+、Cl- |
分析 碱性溶液中含大量的OH-,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,以此来解答.
解答 解:A.碱性溶液中该组离子之间不反应,可大量共存,故A正确;
B.碱性溶液中Fe2+、OH-结合生成沉淀,不能大量共存,故B错误;
C.碱性溶液中该组离子之间不反应,可大量共存,故C正确;
D.碱性溶液中不能大量存在Ca2+、Al3+,故D错误;
故选AC.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
8.现有A、B、C、D四种金属片,
①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;
②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;
③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C.
根据上述情况判断四种金属的活泼由强到弱的顺序为( )
①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;
②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;
③把A、C用导线连接后同时浸入稀硫酸溶液中,电子流动方向为A→导线→C.
根据上述情况判断四种金属的活泼由强到弱的顺序为( )
| A. | DCAB | B. | CBAD | C. | BADC | D. | BACD |
9.苯酚分子结构中化学键如图所示,关于苯酚在各种反应中断键的说明不正确的是( )

| A. | 和氢气发生加成时大π键⑧断裂 | B. | 和金属钠反应时键⑦断裂 | ||
| C. | 和饱和溴水反应时键①、③、⑤断裂 | D. | 制备酚醛树脂时键②、⑥断键 |
6.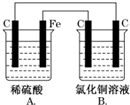 烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
 烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )| A. | A烧杯中电解质溶液pH变大 | |
| B. | B烧杯中阳离子从左向右移动 | |
| C. | 当A烧杯中产生0.1 mol气体时,B烧杯中产生气体为0.1 mol | |
| D. | 一段时间后,B烧杯中溶液的浓度减小 |
13.在标准状况下,将11.2L的HCl溶于水配成0.5L盐酸,则所得溶液的浓度是( )
| A. | 1mol•L-1 | B. | 0.5mol•L-1 | ||
| C. | 22.4mol•L-1 | D. | 缺少密度无法计算 |
3.下列说法中正确的是( )
| A. | 非自发反应一定不能实现 | |
| B. | 自发反应在任何条件下都能实现 | |
| C. | 同种物质气态时熵值最大,固态时熵值最小 | |
| D. | 放热同时熵减的反应高温下才能自发进行 |
10.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法研究影响反应速率的因素.
该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.01mol•L-1、0.001mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.1mol•L-1、0.2mol•L-1;
③催化剂的用量可选择0g、0.5g;
④实验温度可选择298K、323K.
(1)每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4个实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据:(从混合振荡均匀开始计时)
①用0.001mol•L-1KMnO4酸性溶液进行实验时KMnO4的平均反应速率1×10-4mol•L-1•min-1
(忽略混合前后溶液的体积变化)
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?(填“是”或“否”)否.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别与体积相同、浓度相同的高锰酸钾酸性溶液反应,观察溶液褪色的情况.
该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.01mol•L-1、0.001mol•L-1;
②所用H2C2O4溶液的浓度可选择:0.1mol•L-1、0.2mol•L-1;
③催化剂的用量可选择0g、0.5g;
④实验温度可选择298K、323K.
(1)每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL.如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成4个实验进行对比即可得出结论.
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据:(从混合振荡均匀开始计时)
| KMnO4酸性溶液的浓度 (mol•L-1) | 溶液褪色所需时间 (min) | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
(忽略混合前后溶液的体积变化)
②若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?(填“是”或“否”)否.若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液分别与体积相同、浓度相同的高锰酸钾酸性溶液反应,观察溶液褪色的情况.
7.常温下,下列各组离子能大量共存的是( )
| A. | H+、Fe2+、NO3-、SO42- | B. | Na+、H+、AlO2-、HCO3- | ||
| C. | Ca2+、Fe3+、CO32-、CH3COO- | D. | Ca2+、Na+、HCO3-、Cl- |