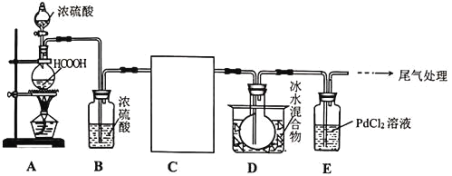
题目内容
【题目】2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化成有机物实现碳循环。如:
C2H4(g)+H2O(l)=C2H5OH(l) ΔH1=-44.2kJ·mol-1
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) ΔH3=___。
(2)CO2甲烷化反应是由法国化学家Sabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如图:
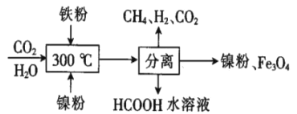
上述过程中,产生H2反应的化学方程式为__。
②HCOOH是CO2转化为CH4的中间体:CO2![]() HCOOH
HCOOH![]() CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是__(填“I”或“Ⅱ”)。
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是__(填“I”或“Ⅱ”)。
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应Ⅱ:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
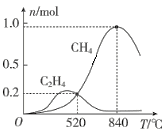
在1L恒容密闭容器中充入1molCO2和4molH2,测得平衡时有关物质的物质的量随温度变化如图所示。520℃时,CO2的转化率为__,520℃时,反应I的平衡常数K=__。
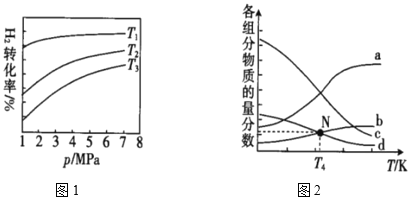
(4)已知CO2催化加氢合成乙醇的反应原理为2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH。m代表起始时的投料比,即m=
C2H5OH(g)+3H2O(g) ΔH。m代表起始时的投料比,即m=![]() 。图1中投料比相同,温度T3>T2>T1,则ΔH___(填“>”或“<”)0。
。图1中投料比相同,温度T3>T2>T1,则ΔH___(填“>”或“<”)0。
②m=3时,该反应达到平衡状态后p(总)=20Mpa,恒压条件下各物质的物质的量分数与温度的关系如图2。则曲线b代表的物质为___(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___。
【答案】+1366.8kJ·mol-1 3Fe+4H2O![]() Fe3O4+4H2 Ⅱ 60% 0.005 < CO2 2.5MPa
Fe3O4+4H2 Ⅱ 60% 0.005 < CO2 2.5MPa
【解析】
(1)C2H4(g)+H2O(l)=C2H5OH(l) ΔH1=-44.2kJ·mol-1
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
利用盖斯定律,将两个热化学方程式直接相加,便可得出2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g)的ΔH3。
(2)转化过程中,发生Fe+H2O(g)的反应,CO2与H2的反应,写出反应方程式,便可确定产生H2反应的化学方程式。
②由前面信息中确定,增加镍粉用量时,导致甲酸产量迅速减少,则表明第二步反应迅速进行。
(3)从图中采集信息,进行计算,从而求出520℃时,CO2的转化率和反应I的平衡常数K。
(4)从图中可看出,降低温度,H2的转化率增大,从而表明降温平衡正向移动,由此可求出ΔH与0的关系。
②温度升高,平衡逆向移动,则反应物的物质的量分数增大,再由起始量关系,确定曲线b代表的物质,T4温度时,利用三段式及图中采集的信息,求出反应达到平衡时物质d的分压p(d)。
(1)C2H4(g)+H2O(l)=C2H5OH(l) ΔH1=-44.2kJ·mol-1
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
利用盖斯定律,将两个热化学方程式直接相加,便可得出2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g)的ΔH3=+1366.8kJ·mol-1。答案为:+1366.8kJ·mol-1;
(2)转化过程中,发生反应:3Fe+4H2O![]() Fe3O4+4H2、CO2(g)+4H2(g)
Fe3O4+4H2、CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)、CO2(g)+H2(g)
CH4(g)+2H2O(g)、CO2(g)+H2(g)![]() HCOOH(ag),便可确定产生H2反应的化学方程式为3Fe+4H2O
HCOOH(ag),便可确定产生H2反应的化学方程式为3Fe+4H2O![]() Fe3O4+4H2。答案为:3Fe+4H2O
Fe3O4+4H2。答案为:3Fe+4H2O![]() Fe3O4+4H2;
Fe3O4+4H2;
②由前面信息中确定,增加镍粉用量时,导致甲酸产量迅速减少,则表明第二步反应迅速进行,则反应速率增加较大的一步是Ⅱ。答案为:Ⅱ;
(3) 520℃时,反应Ⅰ中生成CH40.2mol,则消耗CO20.2mol;反应Ⅱ中生成C2H40.2mol,则消耗CO20.4mol,两反应共消耗CO20.6mol,从而得出CO2的转化率为![]() =60%;反应Ⅰ中生成CH40.2mol,则同时生成H2O0.4mol,消耗CO20.2mol、H20.8mol;反应Ⅱ中生成C2H40.2mol,则消耗CO20.4mol、H21.2mol。两反应共消耗CO20.6mol、H22mol,剩余CO20.4mol、H22mol,反应I的平衡常数K=
=60%;反应Ⅰ中生成CH40.2mol,则同时生成H2O0.4mol,消耗CO20.2mol、H20.8mol;反应Ⅱ中生成C2H40.2mol,则消耗CO20.4mol、H21.2mol。两反应共消耗CO20.6mol、H22mol,剩余CO20.4mol、H22mol,反应I的平衡常数K=![]() =0.005。答案为:60%;0.005;
=0.005。答案为:60%;0.005;
(4)从图中可看出,降低温度,H2的转化率增大,从而表明降温平衡正向移动,由此可求出ΔH<0。答案为:<
②温度升高,平衡逆向移动,则反应物的物质的量分数增大,再由起始量关系,确定曲线a代表H2、b代表CO2,c代表H2O(g)、d代表C2H5OH。T4温度时,m=3,令n(CO2)=2mol,则n(H2)=6mol,设CO2的物质的量为2x,建立如下三段式:
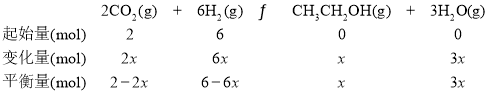
依题意得:2-2x=x,x=![]() ,平衡时乙醇的分压为
,平衡时乙醇的分压为![]() =2.5MPa。答案为:CO2;2.5MPa。
=2.5MPa。答案为:CO2;2.5MPa。