题目内容
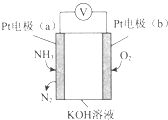
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.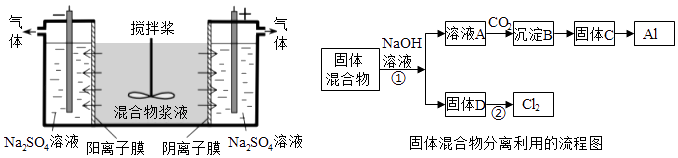
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .
a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .
Ⅱ含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).
【答案】
(1)![]() ;加热(或煅烧);电解法
;加热(或煅烧);电解法
(2)ac
(3)2Cl2(g)+TiO2(s)+2C(s)═TiCl4(l)+2CO(g)△H=﹣85.6kJ?mol﹣1
(4)在直流电场作用下,CrO42﹣通过阴离子交换膜向阳极室移动,脱离浆液;CrO42﹣、Cr2O72﹣;NaOH和H2
【解析】解:(1)NaOH为离子化合物,电子式为 ![]() ,B为Al(OH)3 , 在加热条件下生成氧化铝,电解熔融的氧化铝可得到铝,
,B为Al(OH)3 , 在加热条件下生成氧化铝,电解熔融的氧化铝可得到铝,
故答案为: ![]() ;加热(或煅烧);电解法;(2)反应涉及的条件为加热,加热下可反应,另外加热硫酸,氢离子浓度变化,可知影响的因素为温度和氢离子浓度,故答案为:ac;(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,由质量守恒可知还原性气体为CO,反应的化学方程式为2Cl2(g)+TiO2(s)+2C(s)═TiCl4(l)+2CO(g),则2mol氯气反应放出的热量为
;加热(或煅烧);电解法;(2)反应涉及的条件为加热,加热下可反应,另外加热硫酸,氢离子浓度变化,可知影响的因素为温度和氢离子浓度,故答案为:ac;(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,由质量守恒可知还原性气体为CO,反应的化学方程式为2Cl2(g)+TiO2(s)+2C(s)═TiCl4(l)+2CO(g),则2mol氯气反应放出的热量为 ![]() 4.28kJ=85.6kJ,
4.28kJ=85.6kJ,
所以热化学方程式为2Cl2(g)+TiO2(s)+2C(s)═TiCl4(l)+2CO(g)△H=﹣85.6kJmol﹣1 ,
故答案为:2Cl2(g)+TiO2(s)+2C(s)═TiCl4(l)+2CO(g)△H=﹣85.6kJmol﹣1;(4)电解时,CrO42﹣通过阴离子交换膜向阳极移动,从而从浆液中分离出来,因存在2CrO42﹣+2H+Cr2O72﹣+H2O,则分离后含铬元素的粒子是CrO42﹣、Cr2O72﹣ , 阴极发生还原反应生成氢气和NaOH,
故答案为:在直流电场作用下,CrO42﹣通过阴离子交换膜向阳极室移动,脱离浆液;CrO42﹣、Cr2O72﹣;NaOH和H2 .
Ⅰ.(1)固体混合物含有Al(OH)3、MnO2 , 加入NaOH溶液,过滤,可得到滤液A为NaAlO2 , 通入二氧化碳,生成B为Al(OH)3 , 固体C为Al2O3 , 电解熔融的氧化铝可得到Al;固体D为MnO2 , 加热条件下与浓盐酸反应可生成氯气;(2)题中涉及因素有温度和浓度;(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,由质量守恒可知还原性气体为CO,反应的化学方程式为2Cl2(g)+TiO2(s)+2C(s)═TiCl4(l)+2CO(g),以此可计算反应热并写出热化学方程式;
Ⅱ.(4))电解时,CrO42﹣通过阴离子交换膜向阳极移动,阴极发生还原反应生成氢气和NaOH,以此解答该题.

【题目】CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为﹣24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂. Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓) ![]() CH3Cl+H2O.具体步骤如下:
CH3Cl+H2O.具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集.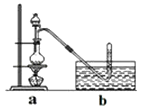
请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是 .
(3)实验室为何用排水法收集CH3Cl?
(4)Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化.现有四只洗气瓶;分别盛有以下试剂: A.1.5%KMnO4(H+)溶液; B.蒸馏水;C.5%Na2SO3溶液; D.98%H2SO4
为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶(填洗气瓶编号),如果观察到则证实上述资料的正确性.
(5)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):
(6)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛的洗气瓶.
(7)某小组同学取VmL被CH3Cl污染的水样与锥形瓶中,用0.10molL﹣1酸性KMnO4溶液进行滴定,实验所得数据如表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.02 | 20.00 | 19.98 |
第一次实验数据出现异常,造成这种异常的原因可能是(填字母代号).
a.锥形瓶洗净后未干燥 b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定过程中振荡锥形瓶时有液体溅出 d.滴定终点时仰视读数.