题目内容
【题目】CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为﹣24.2℃,不易溶于水,易溶于乙醇和丙醇等有机溶剂. Ⅰ.实验室制取CH3Cl的原理是CH3OH+HCl(浓) ![]() CH3Cl+H2O.具体步骤如下:
CH3Cl+H2O.具体步骤如下:
①干燥ZnCl2晶体;
②称取24g研细的无水ZnCl2和量取20mL浓盐酸放入圆底烧瓶,同时量取一定量的甲醇放入分液漏斗中;
③将分液漏斗里的甲醇逐滴滴入烧瓶中并加热,待ZnCl2完全溶解后有CH3Cl气体逸出,可用排水法收集.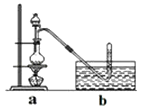
请回答:
(1)实验室干燥ZnCl2晶体制得无水ZnCl2的方法是
(2)反应过程中滴入烧瓶中甲醇的体积比盐酸少(甲醇与浓盐酸的物质的量浓度接近)其理由是 .
(3)实验室为何用排水法收集CH3Cl?
(4)Ⅱ.据某资料记载,CH4分子中的一个H原子被Cl原子取代后,其稳定性受到影响,可被强氧化剂酸性高锰酸钾氧化.现有四只洗气瓶;分别盛有以下试剂: A.1.5%KMnO4(H+)溶液; B.蒸馏水;C.5%Na2SO3溶液; D.98%H2SO4
为证实这一理论的可靠性,请从上面选择最恰当的洗气瓶,将a装置生成的气体依次通过洗气瓶(填洗气瓶编号),如果观察到则证实上述资料的正确性.
(5)写出洗气瓶中发生反应的离子方程式(C元素的氧化产物为CO2):
(6)如果CH3Cl是大气的污染物,上述洗气瓶之后还应接一只盛的洗气瓶.
(7)某小组同学取VmL被CH3Cl污染的水样与锥形瓶中,用0.10molL﹣1酸性KMnO4溶液进行滴定,实验所得数据如表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.02 | 20.00 | 19.98 |
第一次实验数据出现异常,造成这种异常的原因可能是(填字母代号).
a.锥形瓶洗净后未干燥 b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定过程中振荡锥形瓶时有液体溅出 d.滴定终点时仰视读数.
【答案】
(1)在干燥的HCl气氛中加热
(2)增大盐酸的量以提高甲醇的转化率
(3)CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体
(4)BAC;A紫色褪去
(5)10CH3Cl+14MnO4﹣+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32﹣+Cl2+H2O=SO42﹣+2Cl﹣+H+
(6)乙醇
(7)bd
【解析】解:Ⅰ.(1)在加热ZnCl2晶体时可选择通HCl气体抑制其水解,所以答案是:在干燥的HCl气氛中加热;(2)为了提高甲醇的利用率,可以适当增加盐酸的量,所以答案是:增大盐酸的量以提高甲醇的转化率;(3)因CH3Cl中混有易溶于水的杂质气体,用排水法可以即除杂又可收集,所以答案是:CH3Cl不易溶于水,用排水法可除去HCl、CH3OH等杂质气体;Ⅱ.(1)如果CH3Cl能被强氧化剂酸性高锰酸钾氧化,可选择先通过盛有水的洗气瓶除去可能混合有的HCl和甲醇,再通过盛有的酸性高锰酸钾洗气瓶,溶液的紫色会褐去,最后通过盛Na2SO3的洗气瓶吸收生成的氯气防污染,所以答案是:BAC;A紫色褪去;(2)酸性高锰酸钾氧化CH3Cl会生成CO2和Cl2 , 同时自身被还原成Mn2+ , 发生反应的离子方程式为10CH3Cl+14MnO4﹣+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O,生成的氯气经过Na2SO3的洗气瓶会氧化Na2SO3为Na2SO4 , 发生反应的离子方程式为SO32﹣+Cl2+H2O=SO42﹣+2Cl﹣+H+ , 所以答案是:10CH3Cl+14MnO4﹣+42H+=14Mn2++10CO2↑+5Cl2↑+36H2O、SO32﹣+Cl2+H2O=SO42﹣+2Cl﹣+H+;(3)CH3Cl易溶于乙醇和丙醇等有机溶剂,可选择酒精吸收CH3Cl的尾气,所以答案是:乙醇;(4)a.锥形瓶洗净后未干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)= ![]() 分析,c(标准)不变,故a错误;
分析,c(标准)不变,故a错误;
b.酸式滴定管用蒸馏水洗净后未用标准液润洗,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)= ![]() 分析,c(标准)偏大,故b正确;
分析,c(标准)偏大,故b正确;
c.滴定过程中振荡锥形瓶时有液体溅出,造成V(标准)偏小,根据c(待测)= ![]() 分析,c(标准)偏小,故c错误;
分析,c(标准)偏小,故c错误;
d.滴定终点时仰视读数,造成V(标准)偏大,根据c(待测)= ![]() 分析,c(标准)偏大,故d正确;
分析,c(标准)偏大,故d正确;
故选bd.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案