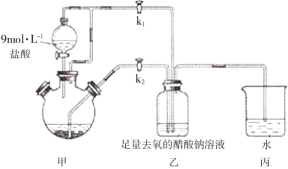
��Ŀ����
����Ŀ����������(![]() ����дΪNaA)���������ϵķ��������о�����������(HA)���־�������������A-����֪25��ʱ��HA��Ka=6.25��10-5��H2CO3��Ka1=4.17��10-7��Ka2=4.90��10-11��������̼�����ϵĹ����У���������NaA�⣬�����ѹ����CO2���壬����˵����ȷ����(�¶�Ϊ25���������������������ɷ�)
����дΪNaA)���������ϵķ��������о�����������(HA)���־�������������A-����֪25��ʱ��HA��Ka=6.25��10-5��H2CO3��Ka1=4.17��10-7��Ka2=4.90��10-11��������̼�����ϵĹ����У���������NaA�⣬�����ѹ����CO2���壬����˵����ȷ����(�¶�Ϊ25���������������������ɷ�)
A�������δ��CO2�����ϣ�̼�����ϵ��־������ϵ�
B�����CO2����ѹ����������c(A-)����
C����pHΪ5.0ʱ��������![]() =0.16
=0.16
D��̼�������и������ӵ�Ũ�ȹ�ϵΪ��c(H+)=c(HCO3-)+c(CO32-)+c(OH-)-c(HA)
���𰸡�C
��������
���������A����������Ϣ��֪��������(HA)���־�������������A-����CO2��������HA��Ũ�Ƚϴ����������δ��CO2�����ϣ�̼�����ϵ��־������ϸߣ���A����B�����CO2����ѹ������Һ��������ǿ����Һ��c(A-)��С����B����C����pHΪ5.0ʱ��������![]() =
=![]() =
=![]() =0.16����C��ȷ��D��̼��������̼��������������ˮ�����������֮�͵�����Һ����������A-��ϵ�������֮�ͣ�����Һ�д��������غ㣺c(H+)+c(HA)=c(HCO3-)+2c(CO32-)+c(OH-)����������ӵ�Ũ�ȹ�ϵΪ��c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(HA)����D����ѡC��
=0.16����C��ȷ��D��̼��������̼��������������ˮ�����������֮�͵�����Һ����������A-��ϵ�������֮�ͣ�����Һ�д��������غ㣺c(H+)+c(HA)=c(HCO3-)+2c(CO32-)+c(OH-)����������ӵ�Ũ�ȹ�ϵΪ��c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(HA)����D����ѡC��

����Ŀ��A��B��C��D��E�� F�����ڱ��ж����ڵ�����Ԫ�أ��й����ʻ�ṹ��Ϣ���±���
Ԫ�� | �й����ʻ�ṹ��Ϣ |
A | �ؿ��к�������Ԫ�� |
B | B��������A�����ӵ�������ͬ���������������е������Ӱ뾶��С�� |
C | C��Bͬ���ڣ���������������ԭ�Ӱ뾶���ģ�ϡ��������⣩ |
D | Dԭ�������������ǵ��Ӳ�����2�������⻯���г�������ζ |
E | E��Dͬ���ڣ����ڸ�������ԭ�Ӱ뾶��С |
F | F���⻯�������������ˮ���ﷴӦ����һ�����ӻ����� |
��1����д��B��D��F����Ԫ�ص����ƣ� �� �� ��
��2��A��C��ԭ�Ӹ�����Ϊ1��1�γɵĻ�����ĵ���ʽΪ ��
��4mol�û�����Ͷ�뵽2L1mol/L BE3��Һ�е����ӷ���ʽ
Ϊ �� ��
��3��д��ʵ�����Ʊ�F���⻯��Ļ�ѧ����ʽ ��
��4����ͼ������ʵ��֤��D��E�ķǽ����Ե�ǿ����

����Һa��b�ֱ�Ϊ �� ��д��ѧʽ����
���ǽ�����D E������ڻ�С�ڣ������ԭ�ӽṹ�ĽǶȽ���ԭ�� ��
����Ŀ����1������ˮ��Һ�������ԣ���ԭ��Ϊ___________________(�����ӷ���ʽ��ʾ)��0.1�İ�ˮ�м���������NH4Cl���壬��Һ��pH________(����ߡ����͡�)����������������������Һ�е�NH4+��Ũ��__________(�����С��)��
��2��25������0.10molL-1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c(S2-)��ϵ��ͼ(������Һ����ı仯��H2S�Ļӷ�)��

��pH=13ʱ����Һ�е�c(H2S)+c(HS-)=_______ molL-1��
��ij��Һ��0.020molL-1Mn2+��0.10molL-1H2S������ҺpH=_______ʱ��Mn2+��ʼ������[��֪��Ksp(MnS)=2.8��10-13]��
��3��25����������ĵ���ƽ�ⳣ�����±���
Ka1 | Ka2 | |
H2SO3 | 1.3��10-2 | 6.3��10-8 |
H2CO3 | 4.2��10-7 | 5.6��10-11 |
��HSO3-�ĵ���ƽ�ⳣ������ʽK=___________________��
��0.10molL-1Na2SO3��Һ������Ũ���ɴ�С��˳��Ϊ___________________��
��H2SO3��Һ��NaHCO3��Һ��Ӧ�����ӷ���ʽΪ___________________��
��4������һ�ֹ�������Ŵ�����������Ǯ����װ�������ִ��ڵ�غ��������ĵ��������й㷺Ӧ�á��ô�������������ڣ�ʧȥ����ɫ�Ĺ���ԭ����___________________����֪Ksp(AgCl)=1.8��10-10������5mL0.018molL-1��AgNO3��Һ�м���5mL0.020molL-1�����ᣬ��Ϻ���Һ�е�Ag+��Ũ��Ϊ_______molL-1��pHΪ__________��