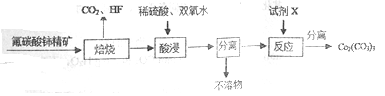
题目内容
【题目】氨气在生产、生活和科研中应用十分广泛。
(1)①SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),SNCR-SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g) ![]() 4N2(g)+6H2O(g)△H=-1627.2kJmol-1;
4N2(g)+6H2O(g)△H=-1627.2kJmol-1;
6NO(g)+4NH3(g) ![]() 5N2(g)+6H2O(g)△H=-1807.0kJmol-1;
5N2(g)+6H2O(g)△H=-1807.0kJmol-1;
6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g)△H=-2659.9kJmol-1;
7N2(g)+12H2O(g)△H=-2659.9kJmol-1;
反应N2(g)+O2(g) ![]() 2NO(g)的△H= ____________ kJmol-1
2NO(g)的△H= ____________ kJmol-1
②液氨可以发生电离:2NH3(l) ![]() NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式____________;
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式____________;
(2)氨气易液化,便于储运①若在恒温恒容的容器内进行反应2NH3(g) ![]() N2(g)+3H2(g);△H=+94.4kJ/mol,下列表示该反应达到平衡状态的标志有____________(填字母序号)
N2(g)+3H2(g);△H=+94.4kJ/mol,下列表示该反应达到平衡状态的标志有____________(填字母序号)
A.容器中混合气体的密度保持不变
B.NH3(g)百分含量保持不变
C.容器中混合气体的压强保持不变
D.有3个H-H键生成同时又1个N≡N键生成
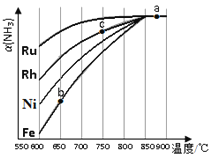
②其他条件相同时,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度的变化如图所示.在600℃时催化效果最好的是____________(填催化剂的化学式).c点氨气的转化率高于b点,原因是____________。
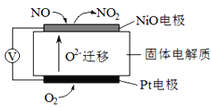
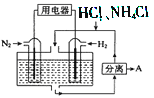
(3)如图表示使用新型电极材料,以N2、H2 为电极反应物,以HCl-NH4Cl为电解质溶液组成的既能提供能量又能实现氮固定的新型电池。请写出该电池的正极反应式____________;生产中可分离出的物质A的化学式为____________。
【答案】
(1)①+179.8;
②COCl2+4NH3=CO(NH2)2+2NH4Cl;
(2)①BC
②Ru;c点温度较高,且Ru比Fe的催化能力更强
(3)N2+8H++6e-═2NH4+;NH4Cl。
【解析】
试题分析:(1)①4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=-1627.2kJmol-1;②6NO(g)+4NH3(g)
4N2(g)+6H2O(g)△H=-1627.2kJmol-1;②6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)△H=-1807.0kJmol-1;③6NO2(g)+8NH3(g)
5N2(g)+6H2O(g)△H=-1807.0kJmol-1;③6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)△H=-2659.9kJmol-1;依据盖斯定律①-②得到N2(g)+O2(g)
7N2(g)+12H2O(g)△H=-2659.9kJmol-1;依据盖斯定律①-②得到N2(g)+O2(g)![]() 2NO(g)△H=+179.8kJmol-1;故答案为:+179.8;
2NO(g)△H=+179.8kJmol-1;故答案为:+179.8;
②由于液氨的电离方程式为2NH3(l)![]() NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,而尿素的化学式为CO(NH2)2,可知该反应的化学方程式为COCl2+4NH3=CO(NH2)2+2NH4Cl,故答案为:COCl2+4NH3=CO(NH2)2+2NH4Cl;
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,而尿素的化学式为CO(NH2)2,可知该反应的化学方程式为COCl2+4NH3=CO(NH2)2+2NH4Cl,故答案为:COCl2+4NH3=CO(NH2)2+2NH4Cl;
(2)①若在恒温恒容的容器内进行反应2NH3(g) ![]() N2(g)+3H2(g);△H=+94.4kJ/mol。A.容器中混合气体的密度始终保持不变,不能表示该反应达到平衡状态的标志,故A错误;B.NH3(g)百分含量保持不变,表示该反应达到平衡状态的标志,故B正确;C.该反应属于气体的物质的量发生变化的反应,容器中混合气体的压强保持不变,表示该反应达到平衡状态的标志,故C正确;D.有3个H-H键生成同时必定有1个N≡N键生成,不能表示该反应达到平衡状态的标志,故D错误;故选BC。
N2(g)+3H2(g);△H=+94.4kJ/mol。A.容器中混合气体的密度始终保持不变,不能表示该反应达到平衡状态的标志,故A错误;B.NH3(g)百分含量保持不变,表示该反应达到平衡状态的标志,故B正确;C.该反应属于气体的物质的量发生变化的反应,容器中混合气体的压强保持不变,表示该反应达到平衡状态的标志,故C正确;D.有3个H-H键生成同时必定有1个N≡N键生成,不能表示该反应达到平衡状态的标志,故D错误;故选BC。
②根据图可知,在600℃时催化效果最好的是Ru,b、c点均未达到平衡,c点温度较高,反应速率较快,氨气的转化率较高,故答案为:Ru;c点温度较高,且Ru比Fe的催化能力更强;
(3)放电过程中,负极电极反应为:H2-2e-=2H+,正极电极反应N2+8H++6e-═2NH4+;生产中可分离出的物质A的化学式为NH4Cl,故答案为:N2+8H++6e-═2NH4+;NH4Cl。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案