题目内容
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
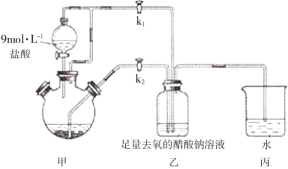
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量。
(1)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为_________。
(2) 实现步骤③中溶液自动转移至装置乙中的实验操作为_________。
(3) 装置丙中导管口水封的目的是__________________。
(4) 为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是_____ 。
A.先用盐酸洗,后用冷水洗 B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗 D.先用乙醇洗涤,后用乙醚洗
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.4g,则该实验所得产品的产率为_________(不考虑溶解的醋酸亚铬水合物,Mr[Cr(CH3COO)2]2·2H2O =376g/mol)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的空气,再加入碱液,调节pH至少为_________才能使铬的离子沉淀完全。
【已知Cr(OH)3的溶度积为6.3×10-31,![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
(7) 一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在。
【答案】(1)Zn+2Cr3+=2Cr2++Zn2+(2分)(2) 关闭k1,打开k2。(2分)
(3) 防止空气进入装置乙中氧化Cr2+。(2分)(4) C(2分)(5)83.3%(2分)(6)5.6(2分)
(7) ①混合气体通入澄清石灰水,溶液变浑浊,说明混合气体中含有CO2。②混合气体通入灼热的CuO,固体颜色由黑色变为红色,说明混合气体中含有CO。(其他合理答案均可) (2分)
【解析】
试题分析:(1)Cr3+具有氧化性,能氧化金属锌,则三颈瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为Zn+2Cr3+=2Cr2++Zn2+。
(2)要实现步骤③中溶液自动转移至装置乙中,则可以借助于压强的变化来实现,由于三颈烧瓶中产生气体,所以实验操作为关闭K1,打开K2。
(3)由于空气中含有氧气,氧气能氧化二价铬,则装置丙中导管口水封的目的是防止空气进入装置乙氧化二价铬。
(4)由于醋酸亚铬水合物是一种氧气吸收剂,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂),所以洗涤产品时,为了去除可溶性杂质和水分,正确使用顺序是先用去氧冷的蒸馏水,然后用乙醇,最后用乙醚,答案选c。
(5)若实验所取用的CrCl3溶液中含溶质9.51g,则根据原子守恒可知理论上得到产品的质量是![]() ,所以产率是
,所以产率是![]() 。
。
(6)当离子的浓度小于10-5mol/L时可以认为沉淀完全,则根据溶度积常数可知溶液中氢氧根的浓度是=![]() ,则氢离子浓度是2.5×10-6mol/L,则pH=5.6。
,则氢离子浓度是2.5×10-6mol/L,则pH=5.6。
(7)二氧化碳能使澄清的石灰水变浑浊,所以可以用澄清石灰水检验二氧化碳;CO具有还原性,可以用氧化铜检验,即混合气体通入澄清石灰水,变浑浊,说明混合气体中含有CO2;混合气体通入灼热的CuO,固体颜色由黑色变红色,说明混合气体中有CO。