题目内容
【题目】氯气是一种黄绿色气体.1974年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
(1)若用这两种方法制氯气,请比较,它们的发生装置使用的不同仪器是 .
(2)现将29g纯度为60%的软锰矿(主要成分MnO2)与足量的浓盐酸充分反应(杂质不参加反应),把反应后所得溶液稀释到200mL.计算: ①生成的Cl2在标准状况下的体积.
②稀释后溶液中MnCl2的物质的量浓度.
【答案】
(1)前者需要酒精灯加热,后者不需要
(2)4.48L| 1mol/L
【解析】解:(1)软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,需在加热条件下进行;用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O,该反应无需加热,所以它们的发生装置使用的不同仪器是前者需要酒精灯加热,后者不需要,故答案为:前者需要酒精灯加热,后者不需要;(2)①29g纯度为60%的软锰矿(主要成分MnO2)中MnO2的物质的量为:
MnCl2+Cl2↑+2H2O,需在加热条件下进行;用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O,该反应无需加热,所以它们的发生装置使用的不同仪器是前者需要酒精灯加热,后者不需要,故答案为:前者需要酒精灯加热,后者不需要;(2)①29g纯度为60%的软锰矿(主要成分MnO2)中MnO2的物质的量为: ![]() mol=0.2mol,则:
mol=0.2mol,则:
MnO2+4HCl(浓) | Cl2↑+2H2O |
1 | 1 |
0.2mol | n(Cl2) |
所以n(Cl2)=0.2mol,故V(n(Cl2)=0.2mol×22.4L/mol=4.48L,
答:标准状况下生成的Cl2的体积为4.48L;
②消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2)=0.2mol,将反应后所得溶液稀释成200mL,稀释后液中MnCl2的物质的量浓度为 ![]() =1mol/L,
=1mol/L,
答:稀释后液中MnCl2的物质的量浓度为1mol/L.
(1)根据反应条件确定制备装置的异同之处;(2)①根据质量分数计算软锰矿中二氧化锰的质量,再根据n= ![]() 计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;
计算二氧化锰的物质的量,根据方程式计算生成的氯气的物质的量,利用V=nVm计算氯气的体积;
②消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2),根据c= ![]() 计算稀释后液中MnCl2的物质的量浓度.
计算稀释后液中MnCl2的物质的量浓度.

【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如图: 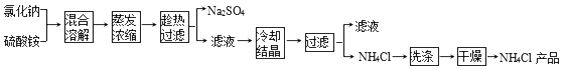
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如图所示: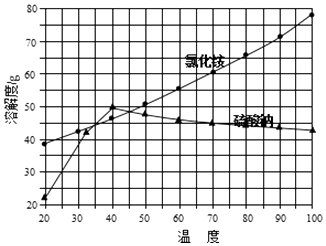
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: .
(2)欲制备10.7g NH4Cl,理论上需NaCl质量为g.
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 .
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 .
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |