题目内容
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如图: 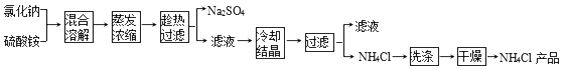
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如图所示: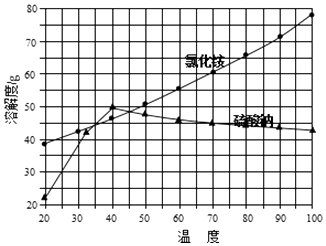
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: .
(2)欲制备10.7g NH4Cl,理论上需NaCl质量为g.
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 .
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 .
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |
【答案】
(1)(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4
(2)11.7
(3)玻璃棒、烧杯、蒸发皿
(4)35℃
(5)加热;如果试管底部没有固体剩余
【解析】解:将氯化钠和硫酸铵混合溶解,蒸发浓缩,根据溶解度曲线可知,在温度较高时,硫酸钠溶解度较小,所以趁热过滤可得硫酸钠固体,溶液中则主要为氯化铵,过滤得氯化铵溶液,将氯化铵溶液冷却结晶,过滤得氯化铵固体,经洗涤干燥得氯化铵产品,(1)硫酸铵和氯化钠相互交换离子生成硫酸钠和氯化铵,反应方程式为(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4,
故答案为:(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4;(2)10.7g NH4Cl的物质的量为 ![]() =0.2mol,根据Cl元素守恒,需要NaCl的物质的量也为0.2mol,质量为0.2mol×58.5g/mol=11.7g,
=0.2mol,根据Cl元素守恒,需要NaCl的物质的量也为0.2mol,质量为0.2mol×58.5g/mol=11.7g,
故答案为:11.7;(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还需要蒸发溶液的蒸发皿、盛放晶体的烧杯、搅拌用的玻璃棒,
故答案为:蒸发皿、烧杯、玻璃棒;(4)根据硫酸钠的溶解度曲线不难看出,在低于40℃时,硫酸钠的溶解度随温度的升高而增大,高于40℃时硫酸钠的溶解度随温度的升高而减小;由两物质的溶解度曲线不难看出,只有在35~45℃时,氯化铵的溶解度小于硫酸钠的溶解度,
故答案为:35℃;(5)加热条件下氯化铵分解生成氨气和氯化氢,如果固体完全是氯化铵,则加热后没有固体剩余,如果有固体剩余就证明氯化铵不纯净,所以其检验方法为:取少量氯化铵产品于试管底部,加热,如果试管底部没有固体剩余,就说明氯化铵纯净,
故答案为:加热;如果试管底部没有固体剩余.
将氯化钠和硫酸铵混合溶解,蒸发浓缩,根据溶解度曲线可知,在温度较高时,硫酸钠溶解度较小,所以趁热过滤可得硫酸钠固体,溶液中则主要为氯化铵,过滤得氯化铵溶液,将氯化铵溶液冷却结晶,过滤得氯化铵固体,经洗涤干燥得氯化铵产品,(1)硫酸铵和氯化钠相互交换离子生成硫酸钠和氯化铵;(2)根据Cl元素守恒计算NaCl的质量;(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还需要蒸发皿、玻璃棒、烧杯;(4)从溶解度曲线判断硫酸钠和氯化铵的溶解度变化特点分析,在35﹣45℃时,氯化铵的溶解度小于硫酸钠的溶解度;(5)氯化铵分解生成氯化氢和氨气,根据固体加热是否有剩余固体确定氯化铵是否除净.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
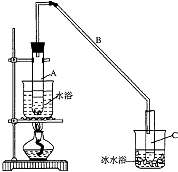
综合自测系列答案【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯 已知: 
密度(g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品 将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯蒸馏即可得到精品.