��Ŀ����
����Ŀ��ʵ������һ�ֹ�ҵ��������Ҫ�ɷ�ΪMgCO3��Mg2SiO4��������SiO2��FeO��Fe2O3��Al2O3��Ϊԭ���Ʊ�MgCO33H2O��ʵ��������£� 
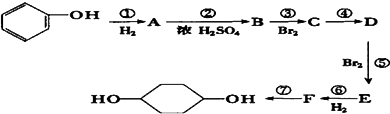
��1��д��Al2O3�����ᷴӦ�����ӷ���ʽ ��
��2�������мӿ췴Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ������д�����ּ��ɣ���
��3������a����Ҫ�ɷ�Ϊ ��
��4������H2O2����ʱ������Ӧ�����ӷ���ʽΪ ��
��5�����백ˮ��Ŀ���� ��
��6��c�Լ�Ϊ ��
��7����������d���� ��
���𰸡�
��1��Al2O3+6H+=2Al3++3H2O
��2�����ȣ��¶�����
��3��H2SiO3��SiO2
��4��H2O2+2Fe2++2H+�T2Fe3++2H2O
��5����ȥ��Һ�������Ӻ�������
��6��Na2CO3��Һ
��7�����ˡ�ϴ�ӡ����¸���
���������⣺��ҵ��������Ҫ�ɷ�ΪMgCO3��Mg2SiO4��������SiO2��FeO��Fe2O3��Al2O3��������40%���������ܣ����˺���Һ�к�������þ�������������������Լ�������������aΪH2SiO3��SiO2 �� ����H2O2�����������ӣ�Ȼ����백ˮ����PHֵ��������ˮ����������������������ˮ�������������������˵�����bΪ����������������������ҺΪ����þ������淋Ļ����Һ����Һ�м���̼������Һ��������MgCO33H2O�����������Լ�cΪNa2CO3 �� �����ˡ�ϴ�ӡ����¸���õ�MgCO33H2O����1��Al2O3�����ᷴӦ�����ӷ���ʽΪAl2O3+6H+=2Al3++3H2O�����Դ��ǣ�Al2O3+6H+=2Al3++3H2O����2�����ȣ��¶����ߣ�������Ӧ���ʣ����ӿ��������ʣ�
���Դ��ǣ����ȡ��¶����ߣ���3����������ķ���������a����Ҫ�ɷ�ΪH2SiO3��SiO2 ��
���Դ��ǣ�H2SiO3��SiO2����4������H2O2����ʱ�����������������������ӣ���Ӧ�����ӷ���ʽΪH2O2+2Fe2++2H+�T2Fe3++2H2O��
���Դ��ǣ�H2O2+2Fe2++2H+�T2Fe3++2H2O����5����������ķ��������백ˮ��Ŀ���ǵ���PHֵ��������ˮ����������������������ˮ�����������������Ӷ���ȥ��Һ�������Ӻ������ӣ�
���Դ��ǣ���ȥ��Һ�������Ӻ������ӣ���6����������ķ�����c�Լ�ΪNa2CO3��Һ��
���Դ��ǣ�Na2CO3��Һ�� ��7��������þ��Һ�м���̼������Һ��������MgCO33H2O�����������ˡ�ϴ�ӡ����¸���õ�MgCO33H2O�����Բ���d�Ĺ���Ϊ��
���Դ��ǣ����ˡ�ϴ�ӡ����¸��

 ��У����ϵ�д�
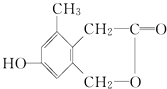
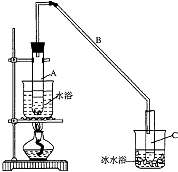
��У����ϵ�д�����Ŀ��ij��ѧС���������������������װ�ã���ͼ�����Ի������Ʊ�����ϩ ��֪�� 
�ܶȣ�g/cm3�� | �۵� ���棩 | �е� ���棩 | �ܽ��� | |
���Ѵ� | 0.96 | 25 | 161 | ������ˮ |
����ϩ | 0.81 | ��103 | 83 | ������ˮ |
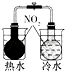
��1���Ʊ���Ʒ ��12.5mL�����������Թ�A�У��ټ���1mLŨ���ᣬҡ�Ⱥ�������Ƭ��������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
��A�����Ƭ�������� �� ����B���˵�������е������� ��
���Թ�C���ڱ�ˮԡ�е�Ŀ���� ��
��2���Ʊ���Ʒ �ٻ���ϩ��Ʒ�к��л������������������ʵȣ����뱥��ʳ��ˮ�������á��ֲ㣬����ϩ���㣨���ϻ��£�����Һ�����������ţ�ϴ�ӣ�
a��KMnO4��Һ b��ϡH2SO4 c��Na2CO3��Һ
���ٽ�����ϩ���ɵõ���Ʒ��
����Ŀ������ѡ����ͼ��ʾ��ʵ�飬���ܴﵽʵ��Ŀ���ǣ� ��
A | B | C | D |
|
|
|
|
֤���¶ȶ�ƽ���ƶ���Ӱ����֤ | ʵ���˻�ѧ��������ת�� | ��֤��������������ʴ | �Ʊ����������� |
A.A
B.B
C.C
D.D